
科目: 来源: 题型:选择题
| A. | 酸性强弱:HI>HBr>HCl>HF | B. | 还原性强弱:F->Cl->I- | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 原子半径大小:Na>S>O |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| B. | HF、HCl、HBr、HI的热稳定性依次增强 | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题


查看答案和解析>>
科目: 来源: 题型:推断题

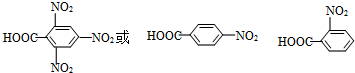 (其中一种)(写结构简式,一种即可).
(其中一种)(写结构简式,一种即可). +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaCl
+NaCl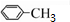 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl;反应④是取代反应 (填反应类型).
+HCl;反应④是取代反应 (填反应类型).查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com