
科目: 来源: 题型:解答题
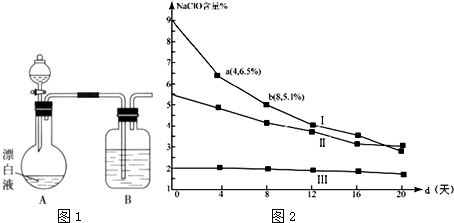
查看答案和解析>>
科目: 来源: 题型:推断题
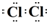 ,该反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
,该反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.查看答案和解析>>
科目: 来源: 题型:解答题
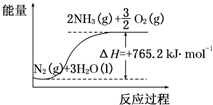 一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目: 来源: 题型:解答题
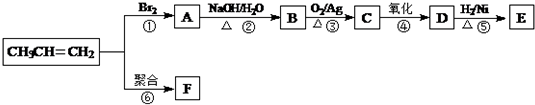
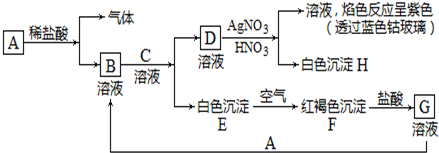
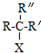 $\stackrel{NaOH/H_{2}O}{→}$
$\stackrel{NaOH/H_{2}O}{→}$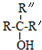 (X为卤素原子,R,R′,R″均为烃基或H原子)
(X为卤素原子,R,R′,R″均为烃基或H原子)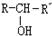 $\stackrel{O_{2}/Ag}{→}$
$\stackrel{O_{2}/Ag}{→}$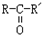 ,
,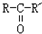 $\stackrel{H_{2}/Ni}{→}$
$\stackrel{H_{2}/Ni}{→}$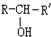
 ; D的结构简式是O=C(CH3)COOH.
; D的结构简式是O=C(CH3)COOH. .
.查看答案和解析>>
科目: 来源: 题型:解答题
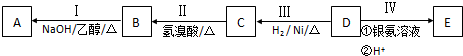
 ;
; ;
; 和
和 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 稀硝酸和过量铁屑反应 3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | 氯化铝溶液和过量的氨水反应 Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 碳酸钠溶液中加入过量苯酚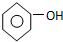 +CO32-→ +CO32-→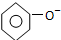 +HCO3- +HCO3- | |
| D. | 次氯酸钙溶液中通入过量CO2 ClO-+CO2+H2O═HClO+HCO3- |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:推断题
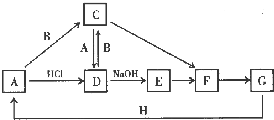 A~H 是中学化学中常见的物质,转化关系如下图所示(部分反应物、反应条件和产物已略去).A、H 是常见的金属单质,工业上常用电解法冶炼H;通常状况下B 为黄绿色气体;G 为红棕色固体;C、D、E、F、G 物种化合物含有同一种元素.
A~H 是中学化学中常见的物质,转化关系如下图所示(部分反应物、反应条件和产物已略去).A、H 是常见的金属单质,工业上常用电解法冶炼H;通常状况下B 为黄绿色气体;G 为红棕色固体;C、D、E、F、G 物种化合物含有同一种元素. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 步骤①中发生的主要反应为Cl2+2Br-═Br2+2Cl- | |
| B. | 步骤②③的目的是富集溴元素 | |
| C. | 物质X 为HBrO | |
| D. | 空气吹出法用到了溴易挥发的性质 |
查看答案和解析>>
科目: 来源: 题型:选择题
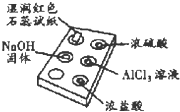 利用点滴板探究氨气的性质(如图所示).实验时向NaOH 固体上滴几滴浓氨水后,立即用表面皿扣住点滴板.下列对实验现象的解释正确的是( )
利用点滴板探究氨气的性质(如图所示).实验时向NaOH 固体上滴几滴浓氨水后,立即用表面皿扣住点滴板.下列对实验现象的解释正确的是( )| 选项 | 实验现象 | 解释 |
| A | 湿润红色石蕊试纸变蓝 | NH3极易溶于水 |
| B | 浓硫酸附近无白烟 | NH3与浓硫酸不发生反应 |
| C | 浓盐酸附近产生白烟 | NH3与挥发出的HCl反应:NH3+HCl═NH4Cl |
| D | AlCl3溶液变浑浊 | NH3与AlCl3溶液反应:Al3++3OH═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com