
科目: 来源: 题型:实验题

组号 | 反应温度 (℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/ml | c/mol•L-1 | V/ml | c/mol•L-1 | V/ml | ||
| A | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | a |
| C | 30 | 5 | 0.1 | 10 | 0.1 | 5 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子中键的极性越强,分子越稳定 | |
| B. | 若把H2S写成H3S,违背了共价键的饱和性 | |
| C. | 分子中共价键的键能越大,键越长,则分子越稳定 | |
| D. | 分子中共价键的键能越大,该物质的性质越不活泼 |
查看答案和解析>>
科目: 来源: 题型:解答题
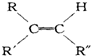 $→_{②Zn/H_{2}O}^{①O_{3}}$
$→_{②Zn/H_{2}O}^{①O_{3}}$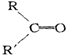 +
+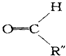 .
. ,C
,C ,E
,E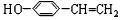 .
.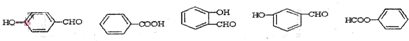 .
.查看答案和解析>>
科目: 来源: 题型:解答题
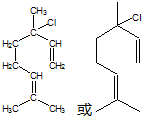
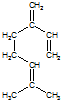 ,也可简写为
,也可简写为 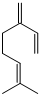 ,其分子式是C10H16,可以发生的化学反应有①④(选填序号).
,其分子式是C10H16,可以发生的化学反应有①④(选填序号).
 .
.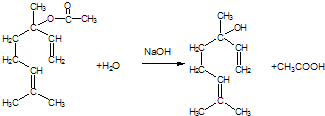 .
.查看答案和解析>>
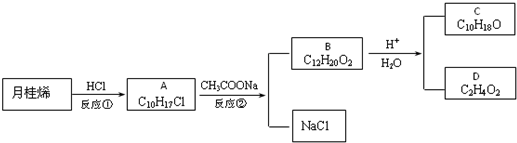
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
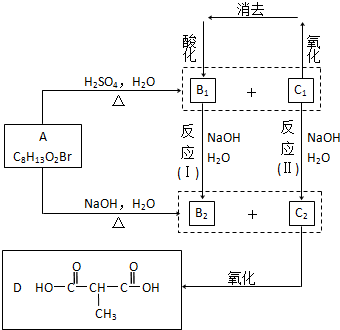
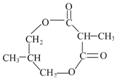 .
.查看答案和解析>>
科目: 来源: 题型:解答题

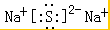 ,A的晶体类型离子晶体.
,A的晶体类型离子晶体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com