
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol Al与含1mol H2SO4的稀硫酸溶液反应 | |
| B. | 1mol Cu与含4mol HNO3的浓硝酸溶液反应 | |
| C. | 1 mol Cu与含2 mol H2SO4的浓硫酸共热 | |
| D. | 1 mol MnO2与足量浓盐酸共热 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 molNa2O2溶于足量水,电子转移数为NA | |
| B. | 1L0.5mol/L C2H5OH溶液中含有的氢原子数为3NA | |
| C. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| D. | 标准状况下,2.24 LCCl4含有的共价键数为0.4NA |
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ① | ③ | ④ | ⑧ | ⑨ | |||
| 4 | ② |
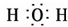 ,
, .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向NaAlO2溶液中加入适量的稀硫酸后,蒸干并灼烧 | |
| B. | 向NaAlO2溶液中通入过量的CO2后,过滤并灼烧 | |
| C. | 向AlCl3溶液中加入适量的NaAlO2溶液后,蒸干并灼烧 | |
| D. | 向AlCl3溶液中加入过量的NaOH溶液后,过滤并灼烧 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径 B>A>C>D | B. | 最高价氧化物水化物的碱性B>A | ||
| C. | 离子半径 C3->D->B+>A2+ | D. | 氢化物的稳定性 C>D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
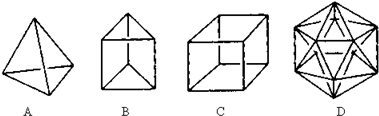
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com