
科目: 来源: 题型:选择题
| A. | 除去甲烷中少量的乙烯:气体通过溴水溶液的洗气瓶 | |
| B. | 除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤,分液、干燥、蒸馏 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸氢钠氢溶液的洗气瓶 | |
| D. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该元素位于第2周期 | |
| B. | 该元素位于第VI A族 | |
| C. | 该元素的氢化物溶于水显碱性 | |
| D. | 该元素最高价氧化物的水化物是一种弱酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.00molNaCl中含有6.02×1023个NaCl分子 | |
| B. | 从100mL,1 mol/L的NaCl溶液中取出10 mL,其物质的量浓度是0.1 mol/L | |
| C. | 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 | |
| D. | 欲配制1.00L,1.00mol•L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 蒸馏时沸石的作用是防止液体受热时突然沸腾(爆沸) | |
| B. | 蒸馏操作时,需要将温度计水银球插入到蒸馏液体的液面以下 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应加热至蒸发皿中溶液全部蒸干 | |
| D. | 用浓硫酸配制稀硫酸时,可将量取好的浓硫酸直接转移至容量瓶后再加水定容 |
查看答案和解析>>
科目: 来源: 题型:解答题
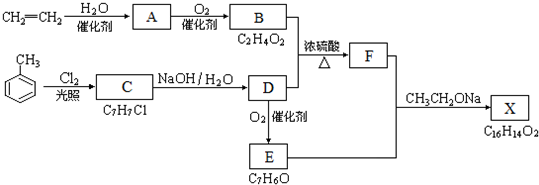
 ;
; ;
;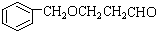 B、
B、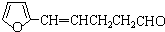
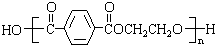 ,其合成单体为
,其合成单体为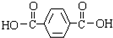 和HOCH2CH2OH;
和HOCH2CH2OH;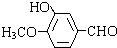 )的重要原料,写出同时满足下列条件的M的同分异构体的结构简式:
)的重要原料,写出同时满足下列条件的M的同分异构体的结构简式: .
.查看答案和解析>>
科目: 来源: 题型:选择题
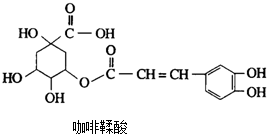 金银花中含有绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法不正确的是( )
金银花中含有绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法不正确的是( )| A. | 绿原酸能与FeCl3发生显色反应 | |
| B. | 1个绿原酸分子中含有4个手性碳原子 | |
| C. | 绿原酸与足量的NaOH反应,其中一种产物的化学式为C9H5O4Na3 | |
| D. | 1mol绿原酸最多能与6molH2发生反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10Be和9Be是中子数不同质子数相同的不同原子 | |
| B. | 10Be的原子核内中子数比质子数多 | |
| C. | 2.6g26Al3+中所含的电子数约为6.02×1023 | |
| D. | 26Al3+和26Mg2+的质子数、中子数和电子数均不相同 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 加入试剂 | 稀硫酸 | 浓硫酸、加热 | 稀硝酸 | 浓硝酸 |
| 实验现象 | 红色固体和蓝色溶液 | 无色气体和蓝色溶液 | 无色气体和蓝色溶液 | 红棕色气体和蓝色溶液 |
| A. | Cu | B. | Cu2O | ||
| C. | 一定有Cu,可能有Cu2O | D. | 一定有Cu2O,可能有Cu |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com