
科目: 来源: 题型:解答题
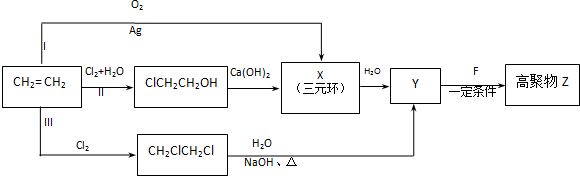
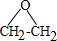 .
.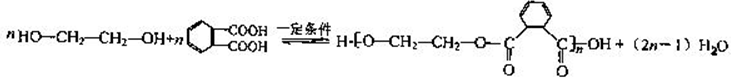 CH2ClCH2Cl→Y:CH2ClCH2Cl+2NaOH$→_{△}^{水}$CH2OHCH2OH+2NaCl.
CH2ClCH2Cl→Y:CH2ClCH2Cl+2NaOH$→_{△}^{水}$CH2OHCH2OH+2NaCl.查看答案和解析>>
科目: 来源: 题型:选择题
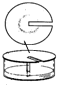 常温下,在丙酮-盐酸混合溶液中,Fe3+比Cu2+的溶解度更大,用该溶液作展开剂分离Fe3+和Cu2+的装置如图.以下叙述错误的是( )
常温下,在丙酮-盐酸混合溶液中,Fe3+比Cu2+的溶解度更大,用该溶液作展开剂分离Fe3+和Cu2+的装置如图.以下叙述错误的是( )| A. | 该方法为径向纸上层析法 | B. | 试样点需浸没于展开剂中 | ||
| C. | 试样点晾干或电风吹干后才能补滴 | D. | 喷浓氨水内层圆环色斑呈绛蓝色 |
查看答案和解析>>
科目: 来源: 题型:解答题
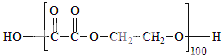 无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用.
无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用.| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75.00% | 11.44% | 13.56% |
查看答案和解析>>
科目: 来源: 题型:实验题
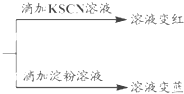
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验序号 | 实验现象 | 实验结论 |
| A | 氯水呈浅黄绿色 | 氯水中含有Cl2 |
| B | 向FeCl2溶液中滴加氯水,溶液变成棕黄色 | 氯水中含有HClO |
| C | 向氯水中滴加硝酸酸化的 AgNO3溶液,产生白色沉淀 | 氯水中含有Cl- |
| D | 向氯水中加入NaHCO3粉末,有气泡产生 | 氯水中含有H+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s 的平均速率 (PCl3)=0.0032mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时 (PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2,反应达到平衡前 (正)>(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0mol PCl3和2.0mol Cl2,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 糖类在一定条件下可以水解生成乙醇和二氧化碳 | |
| B. | 检验淀粉在稀硫酸催化条件下水解产物的方法:取适量水解液于试管中,加入少量新制Cu(OH)2溶液,加热,观察是否出现砖红色沉淀 | |
| C. | 煤制煤气是物理变化,是高效、清洁地利用煤的重要途径 | |
| D. | 蛋白质在紫外线、CuSO4溶液、福尔马林作用下均会发生变性 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com