
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
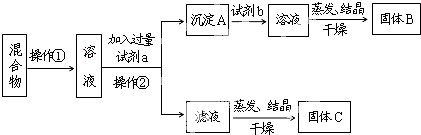
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 阳离子 | Ag+ Ba2+ A13+ |
| 阴离子 | OH- C1- SO42- |
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知25℃时NH4CN溶液显碱性,则25℃时的电离平衡常数K(NH3•H2O)>K(HCN) | |
| B. | 由水电离出的c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.向含有Cl-、CrO42-且浓度均为0.010 mol•L-1溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO42-先产生沉淀 | |
| D. | 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目: 来源: 题型:解答题
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液加入试管中, 加入过量的2mol/L盐酸,再滴加适量1mol/LBaCl2溶液 | 有白色沉淀生成, 证明待测液中含SO42-. |
| 步骤② | 另取少量待测液于试管中,加入足量氯水,再加入四氯化碳,震荡,静置后观察颜色 | 下层出现红棕色,则证明 待测液中含有:Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com