
科目: 来源: 题型:选择题
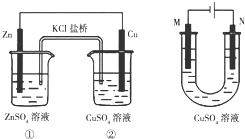
| A. | 装置①将电能转变为化学能 | |
| B. | 装置①中盐桥内的Cl-移向ZnSO4溶液 | |
| C. | 若装置②用于铁棒镀铜,则N极为铁棒 | |
| D. | 若装置②用于电解精炼铜,则溶液中的Cu2+浓度保持不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 可加入酸性KMnO4溶液鉴别苯、环己烯和己烷 | |
| B. | 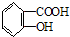 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备 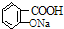 | |
| C. | 向卤代烃水解后的溶液中直接加入硝酸银溶液,可以确定卤代烃中的卤元素 | |
| D. | 利用盐析、过滤可将蛋白质和NaCl溶液分离 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入铝粉能产生H2的溶液:Fe2+、NH4+、SO42-、NO3- | |
| B. | 室温下水电离出c(H+)=1×10-13mol/L的溶液:HCO3-、K+、SO42-、Cl- | |
| C. | 含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl- | |
| D. | 使PH试纸呈深蓝色的溶液:Na+、K+、AlO2-、CO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,0.56 L丙烷中含有共价键的数目为0.25NA | |
| B. | 常温常压下,6.4 g氧气和臭氧的混合气体中含有的原子总数为0.4NA | |
| C. | 惰性电极电解饱和食盐水,若电路中通过NA个电子,则阳极产生气体11.2L | |
| D. | 常温下,20 L pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
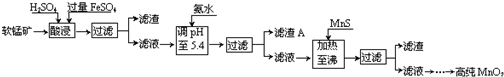
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
查看答案和解析>>
科目: 来源: 题型:实验题
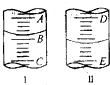 草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100mL水溶液.量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol•L-1的KMnO4溶液滴定,所发生的反应:KMnO4+H2C2O4+H2SO4=K2SO4+CO2↑+MnSO4+H2O
草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100mL水溶液.量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol•L-1的KMnO4溶液滴定,所发生的反应:KMnO4+H2C2O4+H2SO4=K2SO4+CO2↑+MnSO4+H2O查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石蕊试纸和pH试纸使用前都必须用蒸馏水润湿 | |
| B. | 向沸水中滴加饱和氯化铁溶液并不断搅拌,制取氢氧化铁胶体 | |
| C. | 中和滴定实验时,滴定前仰视刻度,滴定后俯视,则对测得浓度无影响 | |
| D. | 滴定管盛装滴定液前需先用蒸馏水洗净,再用滴定液润洗 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 该反应的热化学方程式为:N2(g)+O2(g)=2NO(g)△H=+180 kJ•mol-1 | |
| B. | 1 mol N2(l)和NA个 O2(l)反应生成2mol NO(g)时,吸收的能量为180 kJ | |
| C. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| D. | 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com