
科目: 来源: 题型:选择题
| ① | ② | ③ | ④ | ⑤ |
| 物质微粒数 | 固体体积 | 溶液中溶质的质量分数 | 标准状况下气体的摩尔体积 | 非标准状况下某物质的质量 |
| 阿伏加德罗常数 | 固体密度 | 溶液体积 | 标准状况下气体的体积 | 物质的摩尔质量 |
| A. | ①②⑤ | B. | ②③④ | C. | ①④⑤ | D. | ①③④ |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
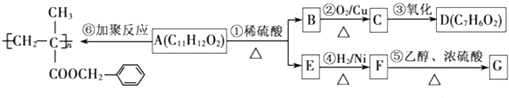
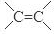 、-COOH;F的名称2-甲基丙酸(系统命名法命名).
、-COOH;F的名称2-甲基丙酸(系统命名法命名).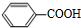 .
.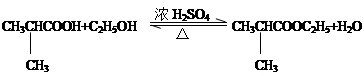 .⑤的反应类型是酯化反应(或取代反应).
.⑤的反应类型是酯化反应(或取代反应).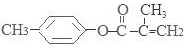 .
.查看答案和解析>>
科目: 来源: 题型:实验题
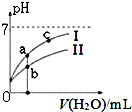 “8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.
“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数( 25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
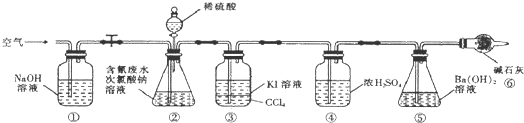
查看答案和解析>>
科目: 来源: 题型:推断题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知酸性H2SO3>HClO>HSO3-,则向Na2SO3溶液中加入HClO的离子方程式为:SO32-+HClO=HSO3-+ClO- | |
| B. | PH=3的HClO溶液,加水稀释后,溶液中所有的离子浓度降低 | |
| C. | 在25°C时,次氯酸的电离方程式及热效应可表示为:HClO(aq)?H+(aq)+ClO-(aq);△H=-(57.3+Q1)kJ•mol-1 | |
| D. | 将20ml 1mol/L HClO溶液与10ml 1mol/L NaOH溶液混合后,所得的混合溶液中一定存在:2c(H+)-2c(OH-)=c(ClO-)-c(HClO) |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 铜的金属活泼性比铁的弱,可在海轮外壳上镶入若干铜块以减缓海轮腐蚀 | |
| B. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 | |
| C. | 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 | |
| D. | 吸热反应TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)在一定条件下可自发进行,则该反应的△S<0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石油的分馏、煤的干馏都是物理变化 | |
| B. | 中和热测定实验用的小烧杯和物质的量浓度溶液配制用的容量瓶都必须干燥 | |
| C. | 酸碱中和滴定时,若用待测液润洗锥形瓶,将导致测定结果偏高(其他操作均正确) | |
| D. | 用铜电极电解2.0 mol•L-1的硫酸,阴阳两极生成气体的体积之比为2:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②⑤ | B. | ②④⑤ | C. | ④⑤⑧ | D. | 全部正确 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:Al3++NH4++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O | |
| B. | 用惰性电极电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- | |
| C. | H218O中投入Na2O2固体:2H218O+2Na2O2=4Na++4OH-+18O2↑ | |
| D. | FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2C12=2Fe3++Br2+4C1- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com