
科目: 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ①② | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②③④⑤⑥① | B. | ③④②⑤① | C. | ③②④⑥⑤① | D. | ④③⑥⑤① |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用Y 表示的化学反应速率为0.005 mol/(L•s) | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若升高温度Y的转化率减小,则正反应为放热反应 | |
| D. | 达到平衡时,Y与Z的浓度相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
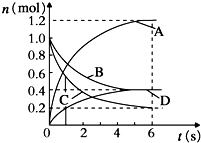 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 该反应的化学方程式为3B+4D?6A+2C | |
| B. | 0~1s内,v(A)=v(c) | |
| C. | 0~6s内,B的平均反应速率为0.05mol/(L•s) | |
| D. | 0~6s内,各物质的反应速率相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 物质的量浓度:c甲=2c乙 | |
| B. | 水电离出的OH-浓度:c(OH-)甲=c(OH-)乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲=乙 | |
| D. | 将甲、乙烧杯中溶液混合后(不考虑体积变化),所得溶液的pH>1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH3•H2O溶液的c(OH-)<NaOH溶液的c(OH-) | |
| B. | c(Na+)=c(NH4+) | |
| C. | 等体积的氢氧化钠和氨水溶液与足量盐酸完全反应,NaOH消耗的盐酸体积多 | |
| D. | 将等体积的氢氧化钠和氨水溶液加水稀释相同倍数,NaOH溶液的pH大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 蒸馏过程中发现未加沸石,应立即补加沸石 | |
| B. | 分液过程中先将下次液体分出,稍等片刻后再分出上层液体 | |
| C. | 海水提溴即用有机溶剂中海水中萃取溴 | |
| D. | 除去NaCl少量KNO3,可先配成饱和溶液,然后蒸发结晶、趁热过滤 |
查看答案和解析>>
科目: 来源: 题型:实验题
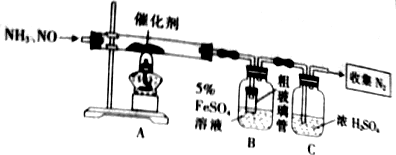
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com