
科目: 来源: 题型:选择题
| A. | Fe3+、Al3+ | B. | Al3+ | C. | Fe2+、NH4+ | D. | Fe3+ |
查看答案和解析>>
科目: 来源: 题型:选择题
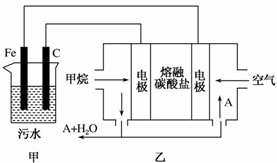 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.某科研小组用该原理处理污水,设计的装置如图所示.下列说法正确的是( )
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.某科研小组用该原理处理污水,设计的装置如图所示.下列说法正确的是( )| A. | 为了增加污水的导电能力,应向污水中加入适量的H2SO4溶液 | |
| B. | 甲装置中Fe电极的反应为Fe-3e-═Fe3+ | |
| C. | 为了使燃料电池乙长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2 | |
| D. | 当乙装置中有1.6 gCH4参加反应时,C电极理论上生成气体的体积在标况下为4.48 L |
查看答案和解析>>
科目: 来源: 题型:实验题
 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.0 | 3.0 |
| 2 | 25.1 | 25.1 | 25.1 | 28.2 | 3.1 |
| 3 | 25.1 | 25.1 | 25.1 | 28.3 | 3.2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 共价化合物中,一定含非金属元素 | |
| B. | 共价化合物中,一定没有离子键 | |
| C. | 离子化合物中可能含有共价键 | |
| D. | 离子化合物中一定含有金属元素和非金属元素 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol Na2O2与足量CO2反应后转移的电子数为NA | |
| B. | 1 mol Fe被氧化时,失去的电子数一定为2 NA | |
| C. | 常温常压下,11.2 L CH4中含有的氢原子数为2 NA | |
| D. | 0.1 mol/L MgCl2溶液中Cl-离子数为0.2 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com