
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
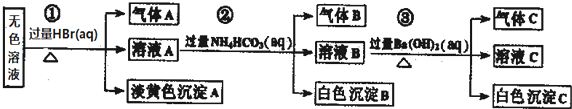
| A. | 根据实验①中的现象可推出,气体A一定是纯净物,淡黄色沉淀一定是AgBr | |
| B. | 根据实验②中的现象可推出,气体B是CO2,沉淀B是Al(OH)3,原溶液中一定含有Al3+ | |
| C. | 根据实验③中的现象可推出,气体C是NH3,沉淀C一定有BaCO3,可能有BaSO4 | |
| D. | 原溶液中肯定含有Na+、AlO2-、S2-,不能确定是否含有SO32-、SO42- |
查看答案和解析>>
科目: 来源: 题型:解答题
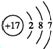 ,B中所含的化学键有离子键、共价键.又知X溶液显碱性,其原因是(用离子方程式表示)ClO-+H2O?HClO+OH-.
,B中所含的化学键有离子键、共价键.又知X溶液显碱性,其原因是(用离子方程式表示)ClO-+H2O?HClO+OH-.查看答案和解析>>
科目: 来源: 题型:解答题
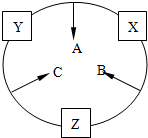 原子序数之和为16的三种短周期元素x、y、z对应的单质 X、Y、Z,常温常压下均为无色气体,在适当条件下单质X、Y、Z之间可以发生如图所示的变化.已知B分子组成中z原子个数比C分子中少一个.
原子序数之和为16的三种短周期元素x、y、z对应的单质 X、Y、Z,常温常压下均为无色气体,在适当条件下单质X、Y、Z之间可以发生如图所示的变化.已知B分子组成中z原子个数比C分子中少一个. .
.查看答案和解析>>
科目: 来源: 题型:实验题
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶 液进行中和热的测定,实验装置如图所示.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶 液进行中和热的测定,实验装置如图所示. | 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 |
| 2 | 25.9 | 25.9 | 25.9 | 29.8 |
| 3 | 26.4 | 26.2 | 26.3 | 30.4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 根据钠和镁分别与冷水的反应情况,判断钠和镁金属性的强弱 | |
| B. | 根据氯水与溴化钠溶液的反应情况,判断氯和溴非金属性的强弱 | |
| C. | 根据HF和HCl的水溶液的酸性强弱,判断氟与氯非金属的强弱 | |
| D. | 根据Na+和K+的氧化性的强弱,判断钠和钾的金属性的强弱 |
查看答案和解析>>
科目: 来源: 题型:解答题
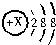
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 必为第1层 | B. | 只能是第2层 | C. | 只能是第3层 | D. | 可以是任意层 |
查看答案和解析>>
科目: 来源: 题型:实验题
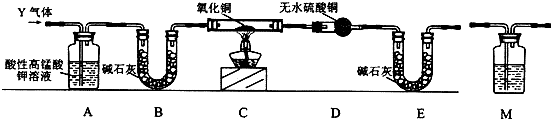
查看答案和解析>>
科目: 来源: 题型:选择题
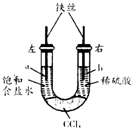 利用如图装置进行实验,开始时,左右两管液面相平,密封好,放置一段时间.下列说法正确的是( )
利用如图装置进行实验,开始时,左右两管液面相平,密封好,放置一段时间.下列说法正确的是( )| A. | 左管中O2得到电子,右管中H+得到电子 | |
| B. | 一段时间后,左管液面低于右管液面 | |
| C. | a、b两处具有相同的电极反应式:Fe-3e-=Fe3+ | |
| D. | a处溶液的pH增大,b处溶液的pH减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com