
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4 LNH3中含有的氢原子数为3NA | |
| B. | 标准状况下,足量Na2O2和11.2LCO2反应,转移电子数目为NA | |
| C. | 常温常压下,16g CH4中所含中子数为10NA | |
| D. | 常温常压下,2.8g乙烯中含有碳氢键的数目为0.2NA |
查看答案和解析>>
科目: 来源: 题型:推断题
| 元素编号 | 元素性质或原子结构 |
| T | 单质是一种淡黄色固体,是黑火药成分之一 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
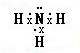 ,其水溶液呈碱性的原因是(用电离方程式表示):NH3•H2O?NH4++OH-.
,其水溶液呈碱性的原因是(用电离方程式表示):NH3•H2O?NH4++OH-.
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 滴定时,左手控制滴定管活塞,右手握锥形瓶,边滴边振荡,眼睛注视滴定管中液面 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口处 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 该绿色食品中不含任何化学物质 | |
| B. | 用蒸馏法可从海水中获得淡水 | |
| C. | ag碳和bg氧气完全反应,一定生成(a+b)g的二氧化碳 | |
| D. | 用规格为10mL的量筒量取6.2mL的液体 |
查看答案和解析>>
科目: 来源: 题型:推断题
 .
.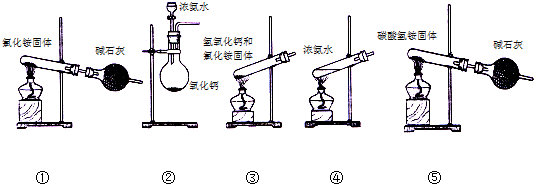
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加热NaHSO4至熔化NaHSO4═Na++H++SO42- | |
| B. | 把CaO放入水中CaO═Ca2++O2- | |
| C. | HClO═H++ClO- | |
| D. | H2S?H++HS-;HS-?H++S2- |
查看答案和解析>>
科目: 来源: 题型:选择题
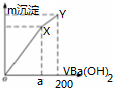
| A. | a=150 | |
| B. | Y点对应溶液为氨水 | |
| C. | OX、XY两段沉淀种类相同 | |
| D. | 继续滴加Ba(OH)2溶液,发生的离子反应为Al(OH)3+OH-═AlO2-+2H2O |
查看答案和解析>>
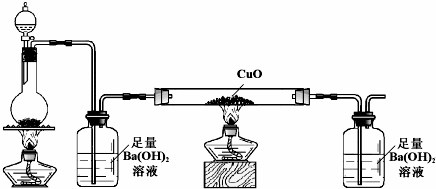
科目: 来源: 题型:解答题
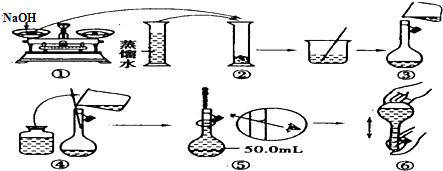
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol任何气体的体积都是22.4L | |
| B. | 1mol H2的质量是1g,它所占的体积是22.4L | |
| C. | 在标准状况下,1mol任何气体所占的体积都约为22.4L•mol-1 | |
| D. | 在标准状况下,1mol任何气体所占的体积都约为22.4L |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com