
科目: 来源: 题型:选择题
| A. | 2.8 g乙烯与丙烯的混合物中含碳原子的数目为0.2NA | |
| B. | 等物质的量的氢氧根离子(OH-)与羟基(-OH)所含电子数相等 | |
| C. | 常温常压下28 g CO与22.4 L O2所含分子数相等 | |
| D. | 16 g CH4与18 g NH4+所含质子数相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
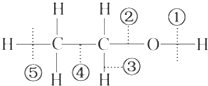
| A. | 和金属钠反应时键①断裂 | |
| B. | 在铜催化共热下与O2反应时断裂①和③ | |
| C. | 在浓H2SO4催化共热下与CH3COOH反应时断裂② | |
| D. | 在空气中完全燃烧时断裂①②③④⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碳纳米管和C60都是单质 | |
| B. | 碳纳米管和金刚石的结构和性质相同 | |
| C. | 碳纳米管和石墨互为同素异形体 | |
| D. | 碳纳米管也能在空气中燃烧生成二氧化碳 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 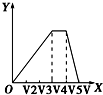 | B. | 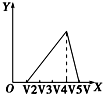 | C. | 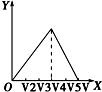 | D. | 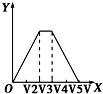 |
查看答案和解析>>
科目: 来源: 题型:推断题
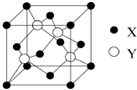 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层的3倍;元素W基态原子的核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层的3倍;元素W基态原子的核外电子共有16种运动状态.查看答案和解析>>
科目: 来源: 题型:选择题
| 元素编号 | a | b | c | d | e | f | g | h |
| 原子半径/nm | 0.037 | 0.071 | 0.075 | 0.082 | 0.102 | 0.143 | 0.152 | 0.093 |
| 最高化合价或最低化合价 | +1 | -1 | -3 | +3 | -2 | +3 | +1 | -1 |
| A. | 元素a与元素c形成的化合物分子中的化学键是极性键 | |
| B. | b元素形成的氢化物分子间存在氢键 | |
| C. | e元素位于周期表中的第二周期ⅥA族 | |
| D. | 元素f的最高价氧化物的水化物能溶于元素h的最高价氧化物的水化物的水溶液中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 2:3 | D. | 1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com