
科目: 来源: 题型:推断题

查看答案和解析>>
科目: 来源: 题型:实验题
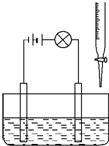 在烧杯里加入20mL 0.1mol/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液.实验装置如图(夹持仪器已去掉):
在烧杯里加入20mL 0.1mol/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液.实验装置如图(夹持仪器已去掉):查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:推断题
| A | B | C | D | E | F | |
| A | ↑↓ | - | - | ↓ | - | |
| B | ↑↓ | ↓ | - | ↓ | ↓ | |
| C | - | ↓ | - | - | ↓ | |
| D | - | - | - | ↓ | - | |
| E | ↓ | ↓ | - | ↓ | ↓ | |
| F | - | ↓ | ↓ | - | ↓ |
查看答案和解析>>
科目: 来源: 题型:实验题
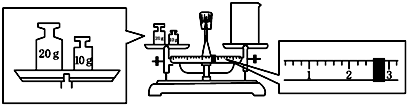
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+、K+、C1O-、I- | B. | C1-、NO3-、Fe2+、Na+ | ||
| C. | K+、Ba2+、OH-、SO42- | D. | Fe3+、NH4+、Br-、NO3- |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 胶体不稳定,静置后容易产生沉淀 | |
| B. | 可用丁达尔效应区别溶液与悬浊液 | |
| C. | 溶液中溶质粒子不能通过半透膜,胶体中分散质粒子能透过半透膜 | |
| D. | 胶体与其他分散系的本质区别是分散质粒子直径在1 nm~100nm之间 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com