
科目: 来源: 题型:实验题
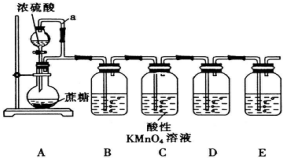
查看答案和解析>>
科目: 来源: 题型:解答题

| T/K | 2.98 | 398 | 498 |
| 平衡常数K | 2.44×10-6 | K1 | K2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4+、NO3-、Al3+、Cl- | B. | K+、SO42-、Ba2+、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | H+、SO42-、HCO3-、Na+ |
查看答案和解析>>
科目: 来源: 题型:推断题
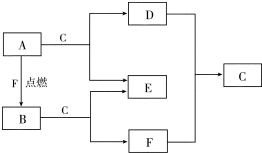 A、D、F均是由短周期元素组成的单质,常温下C是液体.
A、D、F均是由短周期元素组成的单质,常温下C是液体.
查看答案和解析>>
科目: 来源: 题型:选择题
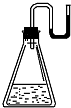 有下列物质:①NaOH固体;②浓硫酸;③NH4NO3晶体;④金属钠.现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内的滴有红墨水的水面呈形如图所示状态,判断加入的物质可能是( )
有下列物质:①NaOH固体;②浓硫酸;③NH4NO3晶体;④金属钠.现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内的滴有红墨水的水面呈形如图所示状态,判断加入的物质可能是( )| A. | ①②③④ | B. | ①②④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 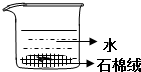 | B. | 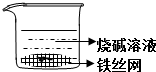 | ||
| C. | 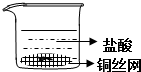 | D. | 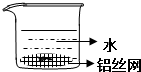 |
查看答案和解析>>
科目: 来源: 题型:解答题
 磷是生物体中不可缺少的元素之一,它能形成多种化合物.
磷是生物体中不可缺少的元素之一,它能形成多种化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com