
科目: 来源: 题型:选择题
| A. | 组成该晶体的微粒为分子 | |
| B. | 1mol该晶体中有2mol共价键 | |
| C. | 该二氧化碳晶体和干冰存在的作用力完全相同 | |
| D. | 一定条件下该晶体能与氢氧化钠反应 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
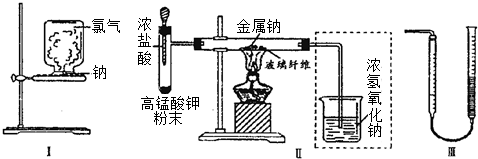
查看答案和解析>>
科目: 来源: 题型:实验题
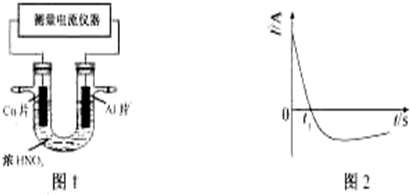
 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
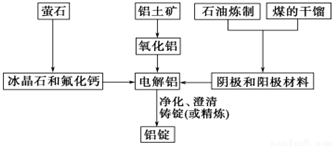
查看答案和解析>>
科目: 来源: 题型:解答题
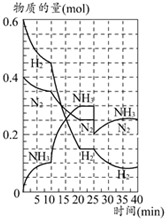 500℃时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示,分析图象完成下列问题:
500℃时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示,分析图象完成下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向银氨溶液中加入足量氢溴酸溶液:Ag(NH3)2++OHˉ+3H+═Ag++2NH4++H2O | |
| B. | 向0.1 mol/L pH=1的NaHA的溶液中加入NaOH溶液:HA-+OH-═H2O+A2- | |
| C. | H2C2O4使酸性KMnO4溶液褪色:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:2Ba2++2SO42-+4OH-+Al3+═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com