
科目: 来源: 题型:解答题
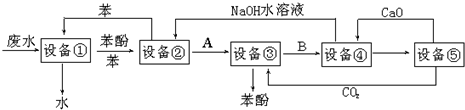
查看答案和解析>>
科目: 来源: 题型:解答题
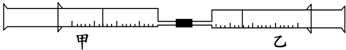
| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒 的现象 |
| 1 | 10mL FeSO4溶液 | 10mL NH3 | 生成白色沉淀,后变色 |
| 2 | 30mL NO2 | 10mL H2O(l) | 剩无色气体 |
| 3 | 15mL Cl2 | 40mL NH3 |
查看答案和解析>>
科目: 来源: 题型:实验题
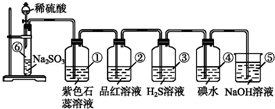
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫酸工业中涉及的3步反应都为氧化还原反应 | |
| B. | 由反应:H2S+Cl2═S↓+2HCl可知,还原性:Cl2>S | |
| C. | 如用NaOH溶液来吸收尾气中的SO2,只能生成一种盐 | |
| D. | 常温下,铝质容器或铁质容器可储运浓硫酸和浓硝酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 高纯硅可用于制造光导纤维 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位 | |
| C. | 硅的化学性质不活泼,在自然界中可以以游离态存在 | |
| D. | 硅在电子工业中,是重要的半导体材料 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H 6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H 6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
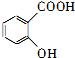 .
. .
. )为主要原料
)为主要原料 制备合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2$\stackrel{Br_{2}}{→}$
制备合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2$\stackrel{Br_{2}}{→}$ .
.查看答案和解析>>
科目: 来源: 题型:解答题
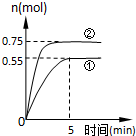 碳循环的途径之一是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ,在容积为2L的密闭容器中充入1mol CO2和3mol H2,在两种不同的实验条件下进行反应,测得CH3OH(g)的物质的量随时间变化情况如图所示:
碳循环的途径之一是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ,在容积为2L的密闭容器中充入1mol CO2和3mol H2,在两种不同的实验条件下进行反应,测得CH3OH(g)的物质的量随时间变化情况如图所示:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 人体中含量位于前6名的元素依次是:氢、氧、X、氮、钙、磷.根据要求用以上元素完成下列填空:
人体中含量位于前6名的元素依次是:氢、氧、X、氮、钙、磷.根据要求用以上元素完成下列填空: ;该分子的空间构型为正四面体结构.
;该分子的空间构型为正四面体结构.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com