
科目: 来源: 题型:选择题
| A. | 甲烷分子的比例模型: | B. | 氯化氢的电子式:H:Cl | ||
| C. | 乙烷的分子式:C2H6 | D. | 乙烯的结构简式:CH2=CH2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④ | B. | ②③⑤ | C. | ①③⑥ | D. | ①②④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入稀氨水,平衡逆向移动,c(OH-)降低,Kw不变 | |
| B. | 加入少量固体CuSO4,c (H+)增大,Kw不变 | |
| C. | 加入少量固体CH3COONa,平衡逆向移动,c (H+)降低,Kw不变 | |
| D. | 加热到90℃,Kw增大,溶液仍呈中性,pH不变 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
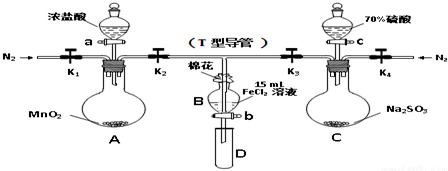
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 100mL 0.1mol•L-1Na2SO4溶液中,钠离子总数是0.2NA | |
| B. | 常温常压下,32gO2中所含电子的数目为16NA | |
| C. | 1mol Al3+含有电子的数目是3NA | |
| D. | 标准状况下,分子数为NA的N2、C2H4混合气体的质量无法确定 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | N2既是氧化产物又是还原产物 | |
| B. | 反应通式配平为6NOx+4xNH3=(3+2x)N2+6xH2O | |
| C. | 当x=1时,每生成2.5mol N2,被氧化的气体有3mol | |
| D. | 当x=2时,有1mol气体被还原时,转移的电子为4mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 目的 | 分离方法 | 原理 |
| A | 使用CCl4提取碘水中的碘 | 萃取、分液 | 碘在CCl4中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去淀粉胶体中的NaCl | 过滤 | 淀粉胶体不能透过滤纸 |
| D | 分离氯化钠和氯化铵 | 升华 | 氯化铵易升华 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com