
科目: 来源: 题型:推断题
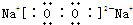 ,其中含有的化学键类型为离子键、非极性键
,其中含有的化学键类型为离子键、非极性键查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 四氟乙烯为非极性分子 | |
| B. | 合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应 | |
| C. | 聚全氟乙丙烯的分子结构可能为【-CF2-CF2--CF2-CF--CF3-】 | |
| D. | ETFE中可能存在“-CH2-CH2-CF2-CF2-”的连接方式 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O=NH3•H2O+H3O+ | |
| B. | 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| C. | 用碳酸氢钠溶液检验水杨酸中的羧基: | |
| D. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
 肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.查看答案和解析>>
科目: 来源: 题型:解答题
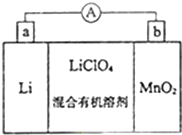 锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:查看答案和解析>>
科目: 来源: 题型:实验题
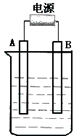 如图所示,在石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色固体物质生成,B电极有黄绿色气体生成,能使淀粉碘化钾试液变蓝.当溶液中的原有溶质完全电解后,停止电解,取出A电极、洗涤、干燥、称量,电极增重1.6g.回答下列问题.
如图所示,在石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色固体物质生成,B电极有黄绿色气体生成,能使淀粉碘化钾试液变蓝.当溶液中的原有溶质完全电解后,停止电解,取出A电极、洗涤、干燥、称量,电极增重1.6g.回答下列问题.查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:解答题
| 金属 | 电子流动方向 | 电压/V |
| Fe | Fe→Cu | +0.78 |
| Zn | Zn→Cu | +1.10 |
| A | Cu→A | -0.15 |
| B | B→Cu | +0.3 |
查看答案和解析>>
科目: 来源: 题型:填空题
 ,最简单烯烃的结构简式为
,最简单烯烃的结构简式为 ,最简单芳香烃的分子式为C6H6,C4H10 的一氯代物有4种,C5H12 的同分异构体中沸点最低的物质 的结构简式为
,最简单芳香烃的分子式为C6H6,C4H10 的一氯代物有4种,C5H12 的同分异构体中沸点最低的物质 的结构简式为 .
.查看答案和解析>>
科目: 来源: 题型:解答题
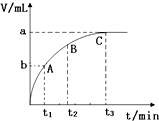 为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.| 编号 | 操 作 | 实验现象 |
| ① | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中. | 试管A中不再产生气泡,试管B中产生的气泡量增大 |
| ② | 另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液. | 试管A、B中均未见气泡产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com