
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 8.48 g | B. | 7.48 g | C. | 5.72 g | D. | 5.22g |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 标准状况下,密度为d g/L的某气体纯净物一个分子的质量为$\frac{22.4}{{N}_{A}}$g | |
| B. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| C. | 25℃时,1 L pH=13的NaOH溶液中含有NA个氢氧根离子 | |
| D. | 4.6 g Na在空气中完全反应生成Na2O、Na2O2,转移0.2NA个电子 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. |  研究的是温度、压强对平衡的影响,横坐标表示压强 | |
| B. | 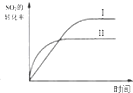 研究的是温度对平衡的影响,Ⅱ采用的温度更高 | |
| C. |  图中t0时使用了催化剂,使平衡向正反应方向进行 | |
| D. | 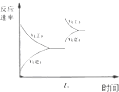 图中t0时增大压强,使平衡向正反应方向进行 |
查看答案和解析>>
科目: 来源: 题型:选择题
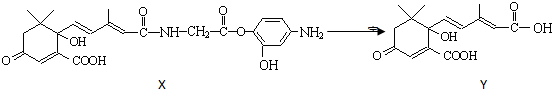 ( )
( )| A. | Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色 | |
| B. | 1 molY与足量NaOH溶液反应,最多消耗3 mol NaOH | |
| C. | 1 molX最多能加成9 molH2 | |
| D. | X可以发生氧化、取代、酯化、加聚、缩聚反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 共价键 | 键能 | 共价键 | 键能 |
| H-H | 436 | H-F | 565 |
| C-F | 427 | H-S | 339 |
| C-Cl | 330 | H-Se | 314 |
| A. | H2(g)→2H (g)-436kJ | |
| B. | 键长越短,共价键越牢固 | |
| C. | 相同条件下CH3F比CH3Cl更 易发生水解反应 | |
| D. | 相同压强下,H2S的沸点比 H2Se的沸点高 |
查看答案和解析>>
科目: 来源: 题型:填空题
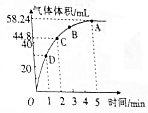 取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)
取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略) | 序号 | 条件 | 现象和结论 | |
| 温度/℃ | 催化剂 | ||
| 1 | 40 | FeCl3溶液 | |
| 2 | 20 | FeCl3溶液 | |
| 3 | 20 | MnO2 | |
查看答案和解析>>
科目: 来源: 题型:解答题
| NaOH 溶液体积/mL | 40.00 | 40.00 | 40.00 |
| 样品质量/g | 7.75 | 15.50 | 23.25 |
| 氨气质量/g | 1.87 | 1.87 | 1.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
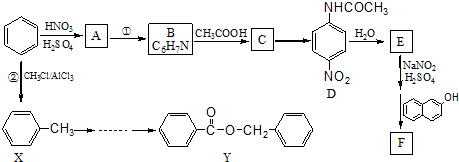
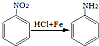
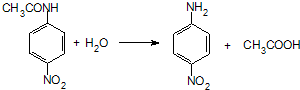
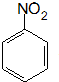
 .
.
 、F
、F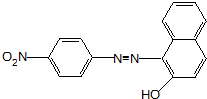 .
.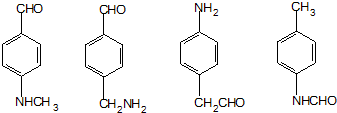 (其中两种)
(其中两种)  .
.查看答案和解析>>
科目: 来源: 题型:解答题
 ).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为: +(CH3CO)2O$→_{85-90℃}^{浓硫酸}$
+(CH3CO)2O$→_{85-90℃}^{浓硫酸}$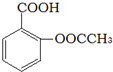 +CH3COOH操作流程如下:
+CH3COOH操作流程如下:
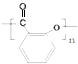 .
.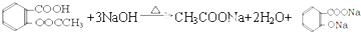 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com