
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
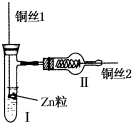 如图为氢气还原氧化铜的微型快速实验装置.实验前先将铜丝1处理成下端弯曲的小圆环,并用铁锤击成带小孔的小匙,将铜丝2一端弯曲成螺旋状.试回答下列问题:
如图为氢气还原氧化铜的微型快速实验装置.实验前先将铜丝1处理成下端弯曲的小圆环,并用铁锤击成带小孔的小匙,将铜丝2一端弯曲成螺旋状.试回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 产品中有被蒸馏出的H2SO4 | B. | 有部分未反应的乙醇被蒸馏出来 | ||
| C. | 有部分未反应的乙酸被蒸馏出来 | D. | 有部分乙醇跟浓硫酸作用生成CO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | FeS的Ksp小于CuS的Ksp | |
| B. | 达到平衡时c(Fe2+)=c(Cu2+) | |
| C. | 该反应平衡常数K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ | |
| D. | 溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Fe2+)保持不变 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
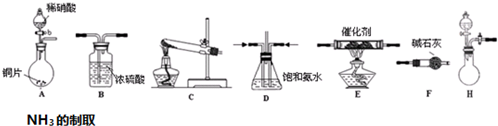
| 试剂组合序号 | 固体试剂(g) | NH3体积(mL) | |
| a | 12.0g Ca(OH)2 (过量) | 10.8g NH4Cl | 2688 |
| b | 10.8g (NH4)2SO4 | 2728 | |
| c | 12.0g NaOH (过量) | 10.8g NH4Cl | 3136 |
| d | 10.8g (NH4)2SO4 | 3118 | |
| e | 12.0g CaO (过量) | 10.8g NH4Cl | 3506 |
| f | 10.8g (NH4)2SO4 | 3584 | |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | R的氧化物都能溶于水 | |
| B. | R的最高价氧化物对应的水化物都是H2RO4 | |
| C. | R一定是非金属元素 | |
| D. | R的最高价氧化物都能与NaOH溶液反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只有②③正确 | B. | 只有①③正确 | C. | 只有④正确 | D. | 均不正确 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用双氧水代替高锰酸钾制氧气 | |
| B. | 用多量的氯气进行性质实验 | |
| C. | 用溴水代替碘水进行萃取实验 | |
| D. | 用铜粉代替铜丝进行铜和浓硝酸的反应 |
查看答案和解析>>
科目: 来源: 题型:解答题

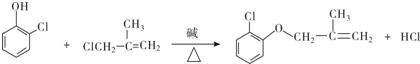 (有机物用结构简式表示,下同).
(有机物用结构简式表示,下同).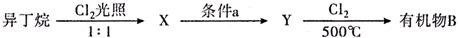
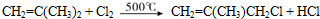 ;
;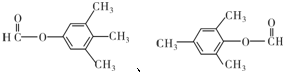
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com