
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
| 温度 | 283K | 293K | 303K |
| 溶解度(g/100g H2O) | 2.5 | 3.9 | 5.6 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | 出现白色沉淀,说明该试剂中有Ba2+存在 |
| 步骤3:取适量步骤1中的沉淀于试管中,滴加稀盐酸连接带塞导气管将产生的气体导入澄清石灰水中. | 澄清石灰水变混浊.说明该试剂中含有BaCO3 |
| 步骤4:取步骤1中的滤液于烧杯中,用pH计测其pH值 | pH值明显大于9.6,说明该试剂中含有Ba(OH)2. |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 混合溶液的pH等于7 | B. | 混合溶液的pH大于7 | ||
| C. | 加入酸碱的物质的量相等 | D. | 混合溶液还能再中和盐酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
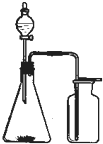 ①浓氨水和固体NaOH制NH3
①浓氨水和固体NaOH制NH3 | A. | ②③ | B. | ①⑥⑦ | C. | ②⑤⑧ | D. | ①④⑥ |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 若pH=7,HA的浓度一定为0.1 mol•L-1 | |
| B. | 若pH>7,HA的pH不可能等于1 | |
| C. | 若pH<7,溶液中的微粒浓度关系为:c(Na+)=c(HA)+c(A-) | |
| D. | 若pH=12,且HA为强酸时,HA的浓度应为0.08 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石头纸不宜在高温条件下生产 | |
| B. | 石头纸能耐酸和碱的腐蚀 | |
| C. | 石头纸不易燃烧 | |
| D. | 使用石头纸,有利于保护森林,且环保 |
查看答案和解析>>
科目: 来源: 题型:解答题
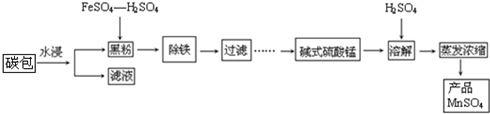
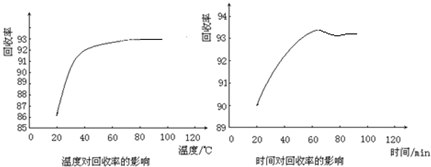
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 0.10 mol•L-1的醋酸钠溶液20mL与0.10 mol•L-1盐酸10mL混合后溶液显酸性:c (CH3COO-)>c (Cl-)>c (H+)>c (CH3COOH) | |
| B. | pH=7的醋酸钠和醋酸混合液中:c(Na+)=c(CH3COO-)=c (H+)=c(OH-) | |
| C. | 若0.10 mol•L-1的醋酸的pH=a,0.010 mol•L-1的醋酸的pH=b,则a+1>b | |
| D. | 已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com