
科目: 来源: 题型:多选题
| A. | 将苯酚晶体放人少量水中,加热至全部溶解,冷却至50℃形成悬浊液 | |
| B. | 苯酚可以和硝酸发生取代反应 | |
| C. | 苯酚易溶于NaOH溶液中 | |
| D. | 苯酚的酸性比碳酸强,比醋酸弱 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同种元素的原子均有相同的质子数和中子数 | |
| B. | 微粒Na+、Mg2+、O2-具有相同的电子层结构 | |
| C. | 短周期第ⅣA与ⅥIA族元素的原子间构成的分子,均满足原子最外层8电子结构 | |
| D. | ${\;}_{20}^{48}$Ca2+的中子数比核外电子数多10 |
查看答案和解析>>
科目: 来源: 题型:多选题
| 选项 | A | B | C | D |
| 物质 | 加碘食盐 | 石英砂 | “84”消毒液 | 水玻璃 |
| 主要成分 | KIO3 | SiO2 | Ca(ClO)2 | NaSiO3 |
| 用途 | 预防碘缺乏病 | 作干燥剂 | 作消毒剂 | 木材防火剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na与水反应时增大水的用量 | |
| B. | Fe与稀硫酸反应制取氢气时,改用浓硫酸 | |
| C. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| D. | 将铝片改为铝粉,做铝与氧气反应的实验 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X的原子半径一定大于Y的原子半径 | |
| B. | X与Y的简单离子不可能具有相同的电子层结构 | |
| C. | X2Y可能是离子化合物,也可能是共价化合物 | |
| D. | 两元素形成的化合物中,原子个数比不可能为1:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙烯和溴单质反应:CH2═CH2+Br2→CH2-CH2Br2 | |
| B. | 合成聚乙烯塑料:nCH2═CH2→ | |
| C. | 皂化反应: +3H2O$→_{△}^{H+}$ +3H2O$→_{△}^{H+}$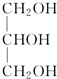 +3C17H35COOH +3C17H35COOH | |
| D. | 乙醇与金属钠反应:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ |
查看答案和解析>>
科目: 来源: 题型:解答题
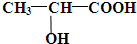
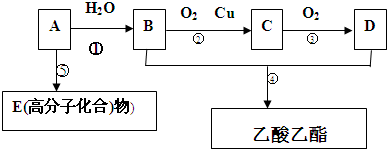
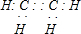
查看答案和解析>>
科目: 来源: 题型:实验题
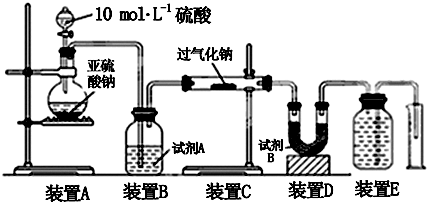
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com