
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
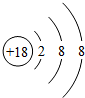 ,由2个原子组成的分子是HCl、由2原子组成具有10电子的阴离子OH-.
,由2个原子组成的分子是HCl、由2原子组成具有10电子的阴离子OH-.查看答案和解析>>
科目: 来源: 题型:推断题

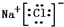 、
、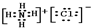
查看答案和解析>>
科目: 来源: 题型:解答题
 ,所含化学键的类型离子键和极性共价键;D、E的最高价氧化物对应水化物发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O用电子式表示BA3的形成过程3H•+
,所含化学键的类型离子键和极性共价键;D、E的最高价氧化物对应水化物发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O用电子式表示BA3的形成过程3H•+ →
→ ,A、C形成的化合物中,C的质量分数最高的化合物的结构式H-O-O-H,C2-的离子结构示意图
,A、C形成的化合物中,C的质量分数最高的化合物的结构式H-O-O-H,C2-的离子结构示意图 ,A有多种同位素,其中一种同位素原子核内有两个中子,这种同位素原子的表示方法31H或T
,A有多种同位素,其中一种同位素原子核内有两个中子,这种同位素原子的表示方法31H或T查看答案和解析>>
科目: 来源: 题型:推断题
 已知X、Y、Z三元素的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.C、D是由X、Y、Z中两种元素组成的化合物,C通常状况下为无色液体,D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板.各物质之间的转换关系如图,部分生成物省略.
已知X、Y、Z三元素的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.C、D是由X、Y、Z中两种元素组成的化合物,C通常状况下为无色液体,D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板.各物质之间的转换关系如图,部分生成物省略.查看答案和解析>>
科目: 来源: 题型:解答题
 如表是部分短周期元素的原子半径及常见化合价如表:
如表是部分短周期元素的原子半径及常见化合价如表:| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.099 | 0.074 | 0.102 |
| 常见化合价 | +2 | +3 | -1 | -2 | +6,-2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  的系统命名法为2,5-二甲基-4-乙基己烷 的系统命名法为2,5-二甲基-4-乙基己烷 | |
| B. | 全降解塑料(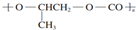 )可由单体环氧丙烷( )可由单体环氧丙烷(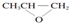 )和CO2加聚制得 )和CO2加聚制得 | |
| C. | 1mol乙酰水杨酸(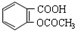 )最多可以和2molNaOH反应 )最多可以和2molNaOH反应 | |
| D. | 油脂、淀粉、蛋白质等高分子化合物都属于混合物,一定条件下均可发生水解 |
查看答案和解析>>
科目: 来源: 题型:推断题

查看答案和解析>>
科目: 来源: 题型:解答题
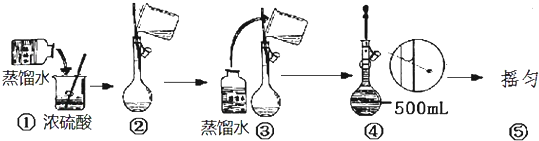

查看答案和解析>>
科目: 来源: 题型:解答题
 ,在B分子中Y原子的杂化方式为sp3,B中O-Y-H的键角小于(填“大于”“等于”或“小于”)A中O-Y-H键角.
,在B分子中Y原子的杂化方式为sp3,B中O-Y-H的键角小于(填“大于”“等于”或“小于”)A中O-Y-H键角.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com