
科目: 来源: 题型:解答题
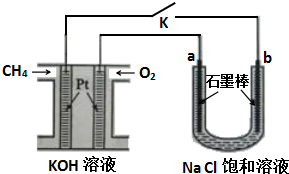
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) | B. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | ||
| C. | c(H+)>c(OH-)>c(Cl-)>c(NH4+) | D. | c(H+)>c(Cl-)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 生成氢气是HCl溶液多 | |
| B. | 生成氢气是CH3COOH溶液多 | |
| C. | 反应速率是HCl溶液与锌反应的快 | |
| D. | 反应速率是CH3COOH溶液与锌反应的快 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 相同 | B. | H2SO4溶液消耗的NaOH多 | ||
| C. | HCl溶液消耗的NaOH多 | D. | 无法比较 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | K正反应=K逆反应 | B. | K正反应>K逆反应 | ||
| C. | K正反应<K逆反应 | D. | K正反应×K逆反应=1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 降低压强能加快化学反应速率 | |
| B. | 使用适当催化剂可以加快化学反应速率 | |
| C. | 升高温度能加快化学反应速率 | |
| D. | 增大压强可以加快此反应的速率 |
查看答案和解析>>
科目: 来源: 题型:解答题
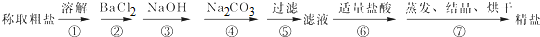
查看答案和解析>>
科目: 来源: 题型:解答题
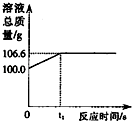 将一定量的CO2通入100g氢氧化钠溶液中恰好完全吸收,形成不饱和溶液,该溶液总质量与反应时间的变化关系如图.试分析解答:
将一定量的CO2通入100g氢氧化钠溶液中恰好完全吸收,形成不饱和溶液,该溶液总质量与反应时间的变化关系如图.试分析解答:查看答案和解析>>
科目: 来源: 题型:解答题
 )的混和物溶于100mL 1mol/L NaOH溶液中,然后用0.5mol/L H2SO4溶液滴定过量的NaOH,消耗硫酸溶液30mL.另取m g上述混和物溶于过量甲醇中,加入少量浓硫酸,加热使完全反应,分离、精制,得到酯的混和物,其质量比 m g增加15.8%,则m的数值为多少?
)的混和物溶于100mL 1mol/L NaOH溶液中,然后用0.5mol/L H2SO4溶液滴定过量的NaOH,消耗硫酸溶液30mL.另取m g上述混和物溶于过量甲醇中,加入少量浓硫酸,加热使完全反应,分离、精制,得到酯的混和物,其质量比 m g增加15.8%,则m的数值为多少?查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com