
科目: 来源: 题型:选择题
| A. | 20mL3mol/L 的 X 溶液 | B. | 20mL2mol/L 的 X 溶液 | ||
| C. | 10mL4mol/L 的 X 溶液 | D. | 10mL2mol/L 的 X 溶液 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题
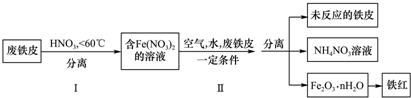
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液、胶体和浊液这三种分散系的根本区别是分散质粒子直径的大小 | |
| B. | 硅单质广泛用于光纤通讯 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na与O2 | B. | NaOH与CO2 | C. | Ca(OH)2与NaHCO3 | D. | Na2O2 与CO2 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| 相关实验 | 预期目的 | |
| A | 相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和醋酸中,观察气泡产生的快慢 | 验证固体接触面积对化学反应速率的影响 |
| B | 可逆反应FeCl3(aq)+3KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq) 建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 | 验证浓度对化学平衡的影响 |
| C | 将MgCl2溶液加热蒸干 | 由MgCl2溶液制备无水MgCl2 |
| D | 相同温度下,两支试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量的MnO2固体 | 验证不同催化剂对H2O2分解速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com