
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3CH2Br$→_{水}^{NaOH}$ CH3CH2OH$→_{170℃}^{浓硫酸}$ CH2=CH2$\stackrel{Br_{2}}{→}$ CH2BrCH2Br | |
| B. | CH3CH2Br $\stackrel{HBr}{→}$ CH2BrCH2Br | |
| C. | CH3CH2Br $→_{水}^{NaOH}$ CH2=CH2 CH2BrCH3$\stackrel{HBr_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Br $→_{醇}^{NaOH}$ CH2=CH2$\stackrel{Br_{2}}{→}$ CH2BrCH2Br |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ③④⑤ | B. | ④⑤ | C. | ④⑤⑦ | D. | ③④⑤⑦ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3CH2CH2OH+CuO $\stackrel{△}{→}$ CH3CH2CHO+H2O+Cu | |
| B. | CH3-C≡CH+HCl $\stackrel{催化剂}{→}$ CH3CCl=CH2 | |
| C. | CH3CH2CH2Cl+NaOH $→_{△}^{醇}$ CH3CH=CH2+NaCl+H2O | |
| D. | CH3CH2CH2Cl+NaOH$\stackrel{△}{→}$ CH3CH2CH2OH+NaCl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | (CH3)3 C-CH=CH2 | B. | CH3CH=C(CH3)C (CH3)3 | ||
| C. | HC≡CCH(CH3)C(CH3)3 | D. | (CH3)3CC(CH3)=CHCH3 |
查看答案和解析>>
科目: 来源: 题型:解答题
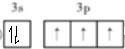 ,上述反应涉及的第二周期元素中第一电离能由大到小的顺序为F>O>C(用元素符号表示).
,上述反应涉及的第二周期元素中第一电离能由大到小的顺序为F>O>C(用元素符号表示).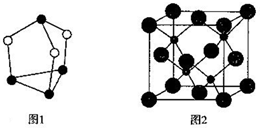
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
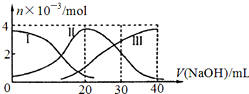
| A. | H2 A在水中的电离方程式是:H2A=H ++HA -;HA -═H++A2- | |
| B. | 当V(NaOH)=20mL时,则有:c(Na + )>c(HA- )>c(H + )>c(A 2- )>c(OH- ) | |
| C. | 当V(NaOH)=30mL时,则有:2c(H + )+c(HA- )+2c(H2A)=c(A 2- )+2 c(OH- ) | |
| D. | 当V(NaOH)=40mL时,其溶液中水的电离受到抑制 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com