
科目: 来源: 题型:选择题
| A. | 在2 min内的反应速率用B表示为0.3 mol/(L•min) | |
| B. | 在2 min内用A表示反应速率是0.4 mol/(L•min) | |
| C. | 在2 min内用C表示反应速率是0.2 mol/(L•min) | |
| D. | 当V正(B)=3V逆(D)时,反应达到平衡 |
查看答案和解析>>
科目: 来源: 题型:解答题
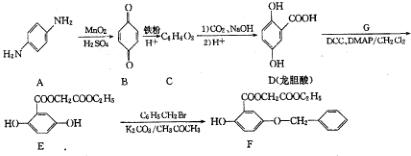
 ;
; ;
;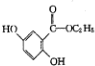 )的一种同分异构体的结构简式
)的一种同分异构体的结构简式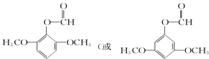 ;
;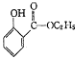 )的合成路线流程图(无机试剂任用),相关信息:
)的合成路线流程图(无机试剂任用),相关信息: .
.查看答案和解析>>
科目: 来源: 题型:解答题
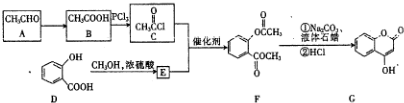
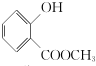 ,G中所含官能团的名称为酯基、碳碳双键、羟基;
,G中所含官能团的名称为酯基、碳碳双键、羟基;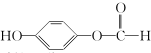 .
.查看答案和解析>>
科目: 来源: 题型:选择题
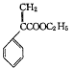 )是一种用于胃肠道平滑肌痉挛及溃疡病的辅助治疗药物,下列说法正确的是( )
)是一种用于胃肠道平滑肌痉挛及溃疡病的辅助治疗药物,下列说法正确的是( )| A. | 不能使酸性KMnO4溶液褪色 | |
| B. | 1mol颠茄酸酯最多与4molBr2发生加成反应 | |
| C. | 能与NaHCO3溶液反应 | |
| D. | 能与NaOH溶液反应 |
查看答案和解析>>
科目: 来源: 题型:推断题
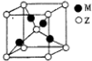 X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的s电子数比p电子数多3个,
X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的s电子数比p电子数多3个,查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 离子半径 | 第一电力能 | 熔点 | 酸性 |
| O2->Na+ | Si<S | NaCl<NaF | HClO4>H2SO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 都是非极性分子 | B. | 中心原子都采取sp杂化 | ||
| C. | S原子和C原子都没有孤对电子 | D. | SO2为V形结构,CO2为直线形结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com