
科目: 来源: 题型:填空题
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | ⑥ | ⑦ | ⑧ | |||||
| 3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
| 4 | ② | ④ |
查看答案和解析>>
科目: 来源: 题型:实验题
 实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液240mL:
实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液240mL:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH2BrCH2Br 二溴乙烷 | B. | CH3OOCCH3 乙酸甲酯 | ||
| C. |  硬酯酸甘油脂 硬酯酸甘油脂 | D. | 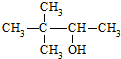 2,2二甲基-3-丁醇 2,2二甲基-3-丁醇 |
查看答案和解析>>
科目: 来源: 题型:实验题
 某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究.
某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究.| 试管编号 | 加入试剂 | 实验现象 |
| Ⅰ | 2滴0.1mol/L FeCl3溶液 | ①白色沉淀转化为红褐色沉淀 |
| Ⅱ | 4mL 2 mol/L NH4Cl 溶液 | ②白色沉淀溶解,得无色溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
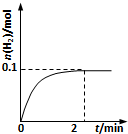 硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应:查看答案和解析>>
科目: 来源: 题型:填空题
| … | ① | ② | ③ | |
| … | ④ | ⑤ |
 .
.查看答案和解析>>
科目: 来源: 题型:填空题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | A | B | ||||||
| 3 | C | D | E | F | H | |||
| 4 | G | R |
查看答案和解析>>
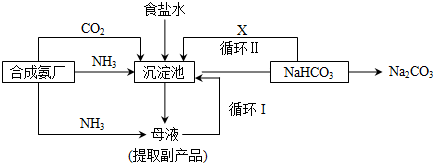
科目: 来源: 题型:选择题
| A. | 侯氏制碱法的主要原料是NaCl、CO2和NH3 | |
| B. | Na2CO3的热稳定性低于NaHCO3 | |
| C. | 该方法的副产物是NH4Cl | |
| D. | 母液可循环利用 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
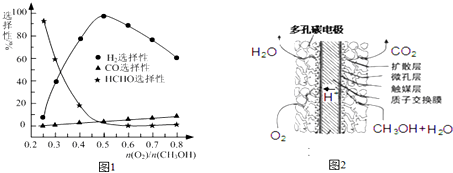
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com