
科目: 来源: 题型:推断题
| 族 周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 |
| 2 | ④ | ⑦ | ||||||
| 3 | ① | ② | ③ | ⑤ | ⑥ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | K+、NH4+、NO3-、OH- | B. | Ag+、K+、SO42-、Cl- | ||
| C. | H+、Na+、OH-、Cl- | D. | Ca2+、Na+、NO3-、Cl- |
查看答案和解析>>
科目: 来源: 题型:推断题
 W、X、Y、Z、M、Q均为稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的电子总数的4倍,Z与M最外层电子数相同,X与M在周期表中的位置如图:
W、X、Y、Z、M、Q均为稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的电子总数的4倍,Z与M最外层电子数相同,X与M在周期表中的位置如图: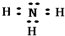 .
.查看答案和解析>>
科目: 来源: 题型:解答题
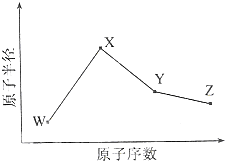 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.查看答案和解析>>
科目: 来源: 题型:实验题
 某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:
某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 第n周期的最后一种金属元素处在第n主族(n>1) | |
| B. | m=1与m=7的元素单质相互化合时,都能形成离子化合物 | |
| C. | 第n周期有8-n种非金属元素(n>1,包括稀有气体元素) | |
| D. | m-n=5的主族元素存在本周期最强的对应含氧酸 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | A、B可能属同一周期 | |
| B. | A位于B的前一周期 | |
| C. | A只能是金属元素 | |
| D. | A可能是第二周期的ⅡA族或ⅣA族元素 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
| C-H | C-O | C=O | H-H | H-O |
| 413.4 | 351 | 745 | 436 | 462.8 |
| 实验 | 温度/℃ | 起始量 | 达到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 所需时间/min | ||
| 1 | 650 | 4 | 2 | 1.6 | 6 | |
| 2 | 900 | 2 | 1 | 1/3 | 3 | |
| 3 | 900 | a | b | c | t | |
查看答案和解析>>
科目: 来源: 题型:填空题
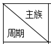 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com