
科目: 来源: 题型:选择题
| A. | vA=0.15mol•L-1•min-1 | B. | vB=0.6mol•L-1•min-1 | ||
| C. | vC=0.4mol•L-1•min-1 | D. | vD=0.01mol•L-1•s-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HSO3-在溶液中发生水解:HSO3-+H2O?SO32-+H3O+ | |
| B. | 向Mg(OH)2浊液中滴加FeCl3溶液生成红褐色沉淀:3OH-+Fe3+=Fe(OH)3↓ | |
| C. | 碳酸氢钠溶液显碱性:HCO3-+H2O?H2CO3+OH- | |
| D. | 惰性电极电解MgCl2溶液:Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$OH-+Cl2↑+H2↑ |
查看答案和解析>>
科目: 来源: 题型:实验题
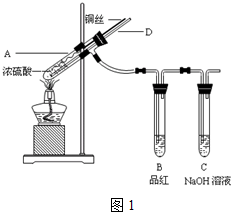

查看答案和解析>>
科目: 来源: 题型:解答题

 .
.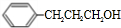
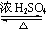
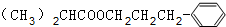 +H2O.
+H2O. .
.查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀 | |
| B. | 除去FeCl2中少量的FeBr2,加入适量氯水,再加四氯化碳萃取分液 | |
| C. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入KNO3固体,铜粉仍不溶解 | |
| D. | 向AlCl3溶液中滴加1mol/L NaOH溶液10ml,产生白色沉淀;再加入1mol/L NaHSO4溶液10ml,沉淀恰好消失 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2 mol•L-1 | B. | 4 mol•L-1 | C. | 6 mol•L-1 | D. | 8 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol Fe与足量H2O(g)反应,转移的电子数为2NA | |
| B. | 10mL pH=6的纯水中含OH-数目为10-10 NA | |
| C. | 1mol羟基中含有的电子数目为9 NA | |
| D. | 100 mL 1 mol/L 的Na2CO3溶液中含有CO32-的数目为0.1NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.01mol | B. | 0.03mol | C. | 0.05mol | D. | 0.07mol |
查看答案和解析>>
科目: 来源: 题型:实验题
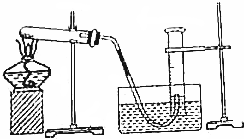
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com