
科目: 来源: 题型:多选题
| A. | Fe2++Cl2→Fe3++2Cl- | |
| B. | 2Fe2++2Br-+2I-+3Cl2=2Fe3++I2+Br2+6Cl- | |
| C. | 2Fe2++4Br-+2I-+4Cl2→2Fe3++I2+2Br2+8Cl- | |
| D. | 4Fe2++2Br-+2I-+4Cl2=4Fe3++I2+Br2+8Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaHA溶液的pH一定大于7 | |
| B. | 在Na2A,NaHA两种溶液中,离子种类相同 | |
| C. | 在Na2A,NaHA两种溶液中都有c(OH-)+c(A2-)=c(H2A)+c(H+) | |
| D. | 在溶质的物质的量相等的Na2A,NaHA两种溶液中,阴离子总数相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3- | |
| B. | pH=1的溶液中:Fe2+、NO3-、SO42- | |
| C. | 水电离出的c(H+)=10-12mol/L的溶液中:Ca2+、Cl-、HCO3- | |
| D. | c (Fe3+)=0.1mol/L的溶液中:K+、SO42-、SCN- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子晶体中,分子间的作用力越大,该分子越稳定 | |
| B. | 分子晶体中,共价键的键能越大,熔、沸点越高 | |
| C. | 原子晶体中,共价键的键能越大,熔、沸点越高 | |
| D. | 某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体 |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题
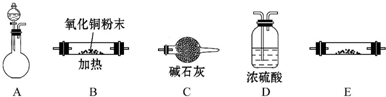
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 |
| 物质 | MnS | CoS | NiS |
| Ksp | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
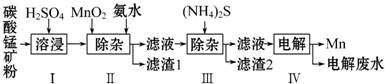
查看答案和解析>>
科目: 来源: 题型:实验题
 实验室需要0.80mol/L NaOH溶液475mL和0.40mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.80mol/L NaOH溶液475mL和0.40mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 以为单位1L 该气体的质量 | B. | 以“克”为单位,VL该气体的质量 | ||
| C. | 1L该气体中所含的分子数 | D. | 以“升”为单位 1mol该气体的体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com