
科目: 来源: 题型:多选题
| A. | 氨水与(NH4)2SO4溶液混合后pH=7的溶液中,[NH4+]:[SO42-] | |
| B. | 相同温度下,0.2 mol•L-1乙酸溶液与0.1 mol•L-1乙酸溶液中,[H+]之比 | |
| C. | Na2CO3溶液中,[Na+]:[CO32-] | |
| D. | pH=12的Ba(OH)2溶液与pH=12的KOH溶液中,c[Ba(OH)2]:c(KOH) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) | |
| B. | CH3COOH溶液加醋酸钠溶液,因醋酸根水解显碱性,电离平衡向正反应方向移动 | |
| C. | CH3COOH溶液中加入少量的CH3COONa固体,平衡逆向移动 | |
| D. | 常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
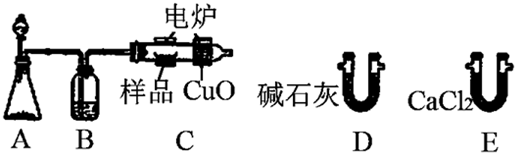
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
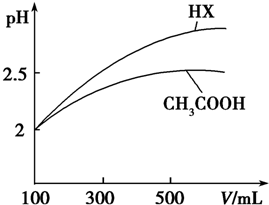
查看答案和解析>>
科目: 来源: 题型:解答题
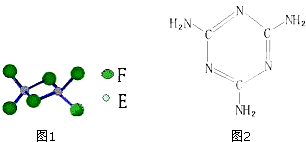
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,11.2LCCl4中含有的分子数目为0.5NA | |
| B. | 常温下,1L0.1mol/LCH3COOH溶液中含有的H+数目为0.1NA | |
| C. | 25℃,PH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| D. | 1L 1mol/L的NH4Cl溶液中,所含NH4+的数目小于NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁原子的电子排布式:[Ar]3d64s2 | B. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | ||
| C. | 氢氧化钠的电子式: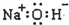 | D. | F的原子结构示意图: |
查看答案和解析>>
科目: 来源: 题型:推断题
 已知:A、B、C、D、E、F六种元素核电荷数依次增大,属于周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:
已知:A、B、C、D、E、F六种元素核电荷数依次增大,属于周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com