
科目: 来源: 题型:选择题
| A. | 12 g C-13含有的原子数为NA个 | |
| B. | 46g NO2和46g N2O4含有的原子数均为3NA | |
| C. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| D. | 标准状况下,2.24L乙醇所含分子数为0.1 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 | |
| B. | 用惰性电极精炼铜时,电解质溶液没有变化 | |
| C. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH | |
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1mol | |
| B. | 一定条件下的可逆反应,反应物的转化率不可能达到100% | |
| C. | 沉淀溶解转换的实质是沉淀溶解平衡的移动,平衡一般向生成更难溶物质的方向移动 | |
| D. | △H<0,△S>0的反应一定是自发进行的化学反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
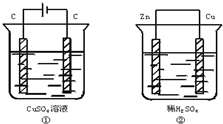 如图两个装置中,溶液体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐水解和溶液体积的变化,则下列叙述正确的是( )
如图两个装置中,溶液体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐水解和溶液体积的变化,则下列叙述正确的是( )| A. | 产生气体的体积:①>② | |
| B. | 电极总质量的变化:①增加,②减小 | |
| C. | 溶液的pH变化:①增大,②减小 | |
| D. | 电极反应式:①装置中的阳极:4OH--4e-→2H2O+O2↑ ②装置中的负极:2H++2e-→H2↑ |
查看答案和解析>>
科目: 来源: 题型:解答题
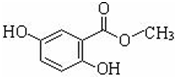 龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.
龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.
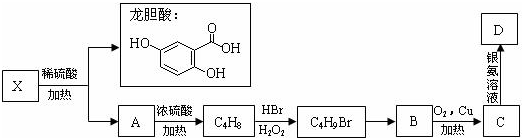
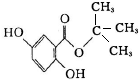

查看答案和解析>>
科目: 来源: 题型:实验题
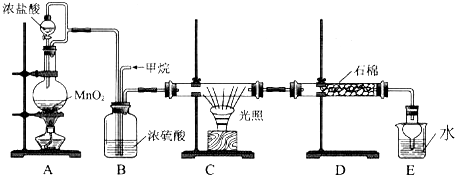
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
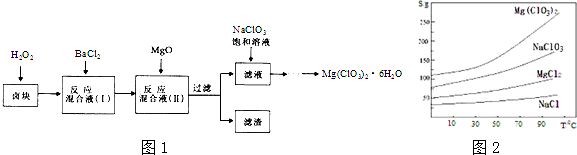
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电子式:次氯酸: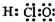 ;过氧化钠: ;过氧化钠: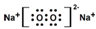 ;羟基: ;羟基: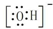 | |
| B. | KHSO4熔融电离:KHSO4=K++H++SO42-;KHCO3溶解于水:KHCO3=K++H++CO32- | |
| C. | 高聚物化学式:聚异戊二烯: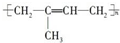 ;PVC: ;PVC: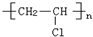 ;PE: ;PE: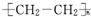 | |
| D. | 下列分子式代表的有机物均有可能与NaHCO3反应放出CO2:C5H12O2、C2H4O2、C7H8O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com