
科目: 来源: 题型:选择题
| A. | ${\;}_{2}^{4}$He原子核内含有4个质子 | B. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | ||
| C. | ${\;}_{2}^{3}$He原子核内含有3 个中子 | D. | ${\;}_{2}^{4}$He具有较强的金属性 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 试管编号 | 实验现象 |
| A | 溶液不变色 |
| B | 溶液缓慢变浅棕褐色 |
| C | 溶液迅速变棕褐色 |

| 开始沉淀 | 完全沉淀 | |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
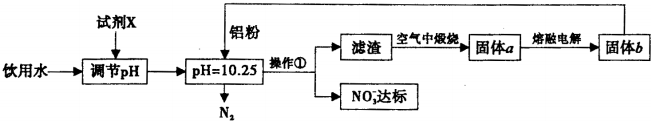
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验目的 | 实验步骤 | |
| A | 比较CH3COOH和H2CO3酸性强弱 | 测同浓度的Na2CO3、CH3COONa溶液的pH |
| B | 比较S和Si非金属性强弱 | 向Na2SiO3溶液中通入SO2出现浑浊 |
| C | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶、过滤 |
| D | 探究蔗糖水解产物中是否含有葡萄糖 | 取少量蔗糖溶液加稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 普通漏斗、玻璃棒、烧杯 | B. | 长颈漏斗、玻璃棒、烧杯 | ||
| C. | 大试管、试管夹、容量瓶 | D. | 分液漏斗、烧杯、铁架台 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 7.8gNa2O2中含有的阴离子数目为0.2Na | |
| B. | 标准状况下,2.24LCHCl3的分子数为0.1NA | |
| C. | 0.1molFe与足量稀HNO3反应,转移电子数为0.3NA | |
| D. | 1L 0.1mol/L Al2(SO4)3溶液中,Al3+的数目为0.2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 按系统命名法,化合物 的名称是 2,5,5-三甲基-3-乙基庚烷 的名称是 2,5,5-三甲基-3-乙基庚烷 | |
| B. | 将 与NaOH的醇溶液共热可制备 CH3-CH═CH2 与NaOH的醇溶液共热可制备 CH3-CH═CH2 | |
| C. | 向柠檬醛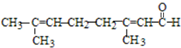 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 | |
| D. | 葡萄糖与果糖、淀粉与纤维素分子式相同,均互为同分异构体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 蒸发时应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 过滤时,将待过滤的物质沿玻璃棒倒入过滤器时,玻璃棒下端应靠在三层滤纸处 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出后,再将上层液体从下口放出到另一个烧杯中 | |
| D. | 蒸馏操作时,温度计应插入在溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com