
科目: 来源: 题型:选择题
| A. | 用药匙取用粉末状或小颗粒状固体 | B. | 用胶头滴管滴加少量液体 | ||
| C. | 给盛有$\frac{2}{3}$体积液体的试管加热 | D. | 倾倒液体时试剂瓶标签面向手心 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 精炼铜时,阳极有1mol物质放电,阴极一定生成NA个铜原子 | |
| B. | 在标准状况下,NA个SO3 分子的质量是80g,其体积就为80/ρ (ρ为SO3的密度) | |
| C. | 1molNaHSO4 熔融液中,其阴阳离子总数目为3NA | |
| D. | PH=1的盐酸溶液中,H+的数目为0.1NA |
查看答案和解析>>
科目: 来源: 题型:解答题
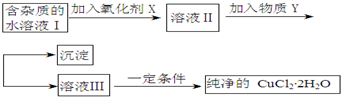
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol•L-1 CH3COONa溶液与0.1 mol•L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1 mol•L-1 NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c (OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.1 mol•L-1 NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1 mol•L-1 Na2C2O4溶液与0.1 mol•L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解饱和食盐水或熔融氯化钠时,阳极的电极反应式均为2Cl--2e-═Cl2↑ | |
| B. | 钢铁发生吸氧腐蚀和析氢腐蚀的负极反应式均为Fe-2e-═Fe2+ | |
| C. | 精炼铜和电镀铜时,与电源负极相连的电极反应式均为Cu2++2e-═Cu | |
| D. | 酸性介质或碱性介质的氢氧燃料电池的正极反应式均为O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 当反应相同体积的CH4时反应①②转移的电子数相同 | |
| B. | 由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H>-574 kJ•mol-1 | |
| C. | 反应②中当生成4.48 L CO2时转移的电子总数为1.60 mol | |
| D. | 若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学反应一定伴随有热量的变化 | |
| B. | 活化能越大的化学反应其反应热数值也越大 | |
| C. | 反应热的产生是由于生成物与反应物的总能量不同 | |
| D. | 放热反应是由于反应物键能总和大于生成物键能总和 |
查看答案和解析>>
科目: 来源: 题型:实验题
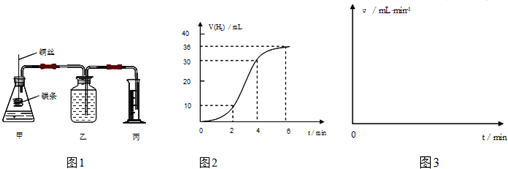
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 25.4% | B. | 50.8% | C. | 6mol/L | D. | 8.36mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,1molSO3的气体体积为22.4L | |
| B. | 1mol铁粉与过量Cl2反应时,转移电子数为2NA | |
| C. | 含有2NA个氧原子的D2O质量为40g | |
| D. | 16gO2分子中含有的氧原子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com