
科目: 来源: 题型:选择题
| A. | 由于浓度差产生放热 | B. | 发生了水分解反应 | ||
| C. | 发生了盐分解反应 | D. | 盐的溶解程度增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
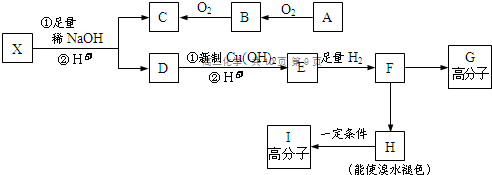
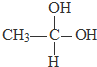 →CH3-CHO+H2O
→CH3-CHO+H2O ;
;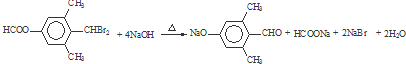 ;
;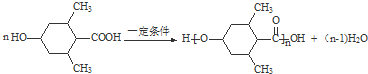 ;
;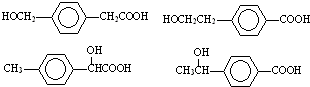 任意一种.
任意一种.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
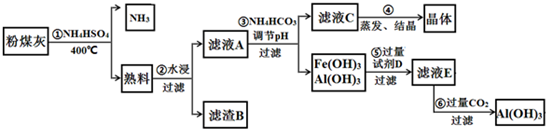
查看答案和解析>>
科目: 来源: 题型:解答题
 ,其中氮的化合价为-2价.
,其中氮的化合价为-2价.查看答案和解析>>
科目: 来源: 题型:解答题
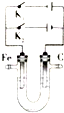 铁及其化合物是一类重要的物质,在人类的生产和生活中具有广泛的用途.
铁及其化合物是一类重要的物质,在人类的生产和生活中具有广泛的用途.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该物质的名称为 2,2,3-三甲基-3-丁烯 | |
| B. | 分子中最多 4 个碳原子共平面 | |
| C. | 此物质转化为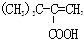 的过程中需依次经过加成、取代、氧化、消去反应 的过程中需依次经过加成、取代、氧化、消去反应 | |
| D. | 此物质与氢气加成后的产物与此物质中氢原子的种类数不同 |
查看答案和解析>>
科目: 来源: 题型:推断题
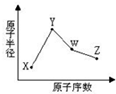 X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数表化如下图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.
X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数表化如下图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.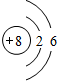 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.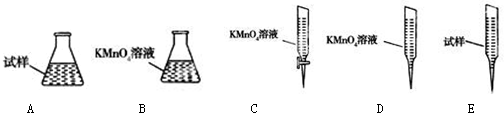
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com