
科目: 来源: 题型:解答题
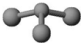 甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系:甲+H2O→丙+丁
甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系:甲+H2O→丙+丁 H++AlO2-+H2O.
H++AlO2-+H2O.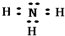 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| 元素代号 | L | M | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | B. | M与T形成的化合物具有两性 | ||
| C. | 气态氢化物的稳定性为H2T>H2R | D. | L和M金属性强弱比较:L>M |
查看答案和解析>>
科目: 来源: 题型:推断题

查看答案和解析>>
科目: 来源: 题型:选择题
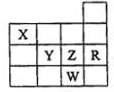
| A. | 常压下五种元素的单质中W单质的沸点最高 | |
| B. | Y、Z和W的阴离子半径依次增大 | |
| C. | X的氢化物比同族元素的氢化物还原性强 | |
| D. | Z元素的最高价氧化物的水化物酸性最强 |
查看答案和解析>>
科目: 来源: 题型:填空题
 的系统命名为2,2,3,-三甲基戊烷;
的系统命名为2,2,3,-三甲基戊烷; 表示的分子式为C4H7Cl.
表示的分子式为C4H7Cl.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 简单离子半径大小顺序:rX>rY>rZ | |
| B. | W的单质和水反应生成两种强电解质 | |
| C. | Y、Z的单质均可通过电解制得 | |
| D. | X的气态氢化物的热稳定性比W的强 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 酚酞不能用作本实验的指示剂 | |
| B. | 盐酸的物质的量浓度为1mol?L-1 | |
| C. | P点时恰好完全中和,溶液呈中性 | |
| D. | 曲线a是盐酸滴定氢氧化钠溶液的滴定曲线 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ,该化合物中化学键类型有离子键、共价键.
,该化合物中化学键类型有离子键、共价键. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4mol | B. | 3mol | C. | 5mol | D. | 2.5mol |
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验次数 | 初读数(mL) | 末读数(mL) |
| 1 | 0.00 | 18.50 |
| 2 | 0.00 | 22.45 |
| 3 | 0.00 | 18.48 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com