
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
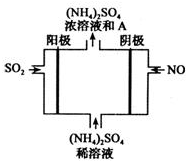 经研究发现,含pM2.5的雾霾主要成分有SO2、NOx、CxHy,及可吸入颗粒等.
经研究发现,含pM2.5的雾霾主要成分有SO2、NOx、CxHy,及可吸入颗粒等.查看答案和解析>>
科目: 来源: 题型:实验题
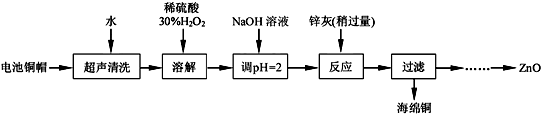
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 完全沉淀的pH | 3.2 | 8.8 | 8.9 |
查看答案和解析>>
科目: 来源: 题型:实验题
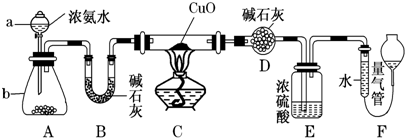
查看答案和解析>>
科目: 来源: 题型:填空题
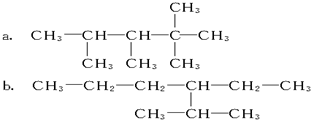
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | S+O2═2SO2;△H=-269kJ/mol(反应热) | |
| B. | 2NO2(g)═O2(g)+2NO(g);△H=+116.2kJ/mol(反应热) | |
| C. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0kJ/mol(燃烧热) | |
| D. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C(s)+O2(g)═CO(g);△H=-393.5 kJ/mol | |
| B. | 2H2(g)+O2(g)═2H2O(g);△H=+571.6 kJ/mol | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-890.3 kJ/mol | |
| D. | $\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2 (g)+3H2O(l);△H=-1400 kJ/mol |
查看答案和解析>>
科目: 来源: 题型:解答题
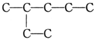
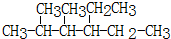 2,3-二甲基-3-乙基己烷
2,3-二甲基-3-乙基己烷 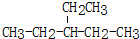 2-乙基戊烷
2-乙基戊烷查看答案和解析>>
科目: 来源: 题型:解答题
 氮元素可形成卤化物、叠氮化物及络合物等.
氮元素可形成卤化物、叠氮化物及络合物等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com