
科目: 来源: 题型:选择题
| A. | 金刚烷(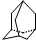 )分子中含有4个 )分子中含有4个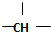 | |
| B. | 利用核磁共振氢谱可以鉴别乙醇和二甲醚 | |
| C. | 高聚物的相对分子质量不一定为单体相对分子质量的整数倍 | |
| D. | 苯、甲苯、乙苯、三硝基甲苯等都是芳香烃 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙醇在一定条件下转化为乙醛,交警用K2Cr2O7检查司机是否酒驾 | |
| B. | 由甲苯硝化制对硝基甲苯,由苯甲酸乙酯水解制苯甲酸和乙醇 | |
| C. | 乙醇分子间脱水成乙醚,溴乙烷在一定条件下脱去HCl成乙烯 | |
| D. | 油酸甘油酯通过氢化反应转变为硬脂酸甘油酯,由丙烯与水反应制丙醇 |
查看答案和解析>>
科目: 来源: 题型:实验题
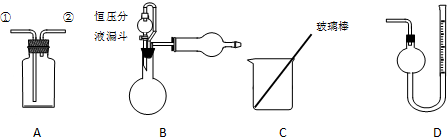
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
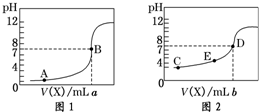 常温下,用 0.10mol•L-1NaOH 溶液分别滴定20.00mL 0.10mol•L-1 HCl溶液和20.00mL 0.10mol•L-1CH3COOH溶液,得到2条滴定曲线,如图所示:
常温下,用 0.10mol•L-1NaOH 溶液分别滴定20.00mL 0.10mol•L-1 HCl溶液和20.00mL 0.10mol•L-1CH3COOH溶液,得到2条滴定曲线,如图所示:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:选择题
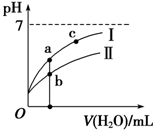 已知:25℃时某些弱酸的电离平衡常数.下面图象表示常温下稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是( )
已知:25℃时某些弱酸的电离平衡常数.下面图象表示常温下稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10 -5 | Ka=3.0×10 -8 | Ka1=4.1×10 -7 Ka2=5.6×10 -11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度大小关系为:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通少量CO2的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c(R-)}{c(HR)•c(OH-)}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度等于b点酸的总浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com