
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:填空题
 (1)科学家正在研究温室气体CH4和CO2的转化和利用.
(1)科学家正在研究温室气体CH4和CO2的转化和利用.查看答案和解析>>
科目: 来源: 题型:填空题
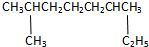 的系统命名是:2,6-二甲基辛烷
的系统命名是:2,6-二甲基辛烷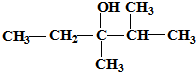 键线式是2,3-二甲基-3-戊醇
键线式是2,3-二甲基-3-戊醇 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备1一溴丁烷的反应和实验装置如图:
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备1一溴丁烷的反应和实验装置如图:| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 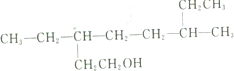 的名称为3,6-二乙基-1-庚醇 的名称为3,6-二乙基-1-庚醇 | B. | 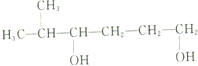 的名称为2-甲基-3,6-己二醇 的名称为2-甲基-3,6-己二醇 | ||
| C. | 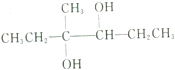 的名称为4-甲基-2,4-己二醇 的名称为4-甲基-2,4-己二醇 | D. | 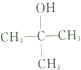 的名称为2-甲基-2-丙醇 的名称为2-甲基-2-丙醇 |
查看答案和解析>>
科目: 来源: 题型:实验题
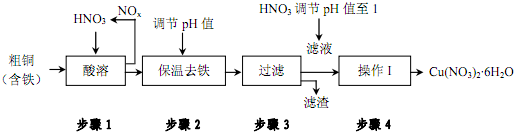
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
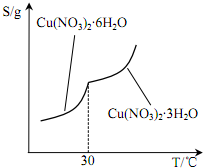
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验探究 | 实验操作及现象 | 结论分析 |
| 探究一 | 将淡蓝绿色粉末溶解于盐酸溶液中,取上清液2份, ①1份滴加BaCl2溶液,产生白色沉淀,再加盐酸,无明显变化. ②另1份溶液先滴加KSCN溶液,无明显变化,再滴加双氧水,后滴加KSCN溶液溶液,变成血红色. | 证明淡蓝绿色粉末为FeSO4 |
| 探究二 | 将红色物质研成粉末,滴加盐酸,无明显变化,再滴加KSCN溶液,无明显现象. | 证明:红色物质不是Fe2O3. |

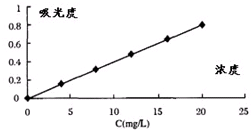
查看答案和解析>>
科目: 来源: 题型:实验题
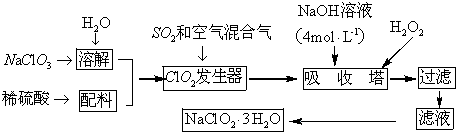
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | ⅠA元素的电负性从上到下逐渐减小,而ⅦA元素的电负性从上到下逐渐增大 | |
| B. | 最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大 | |
| C. | 碳原子由1s22s22p2转化成1s22s12p3,这一过程中释放能量 | |
| D. | NaH的存在能支持可将氢元素放在ⅦA的观点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com