
科目: 来源: 题型:解答题
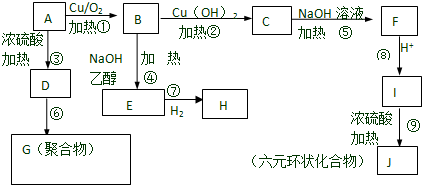
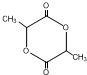 ;
;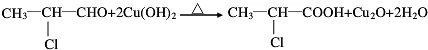 C→F
C→F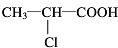 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$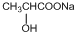 +NaCl+H2O
+NaCl+H2O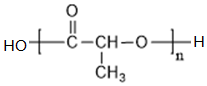 ;
;查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
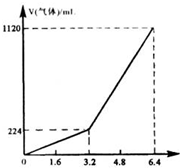 将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A.将质量为m的固体A加入到300mL 2mol/L盐酸中使之完全溶解.测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出).已知:①加入固体A的质量m≤3.2g时,收集到的气体为H2;②当m>3.2g时,收集到的气体为H2和H2S的混合气体.
将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A.将质量为m的固体A加入到300mL 2mol/L盐酸中使之完全溶解.测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出).已知:①加入固体A的质量m≤3.2g时,收集到的气体为H2;②当m>3.2g时,收集到的气体为H2和H2S的混合气体.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯水中:c(Cl2)═2[c(ClO-)+c(Cl-)+C(HClO)] | |
| B. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| C. | 等体积等浓度的氢氧化钠与醋酸混合:c(Na+)>c(CH3COO-) | |
| D. | Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 次氯酸的结构式H-Cl-O | |
| B. | 氯化钠的分子式:NaCl | |
| C. | F-的最外层电子排布式:2s22p5 | |
| D. | D216O中,质量数之和是质子数之和的两倍 |
查看答案和解析>>
科目: 来源: 题型:实验题
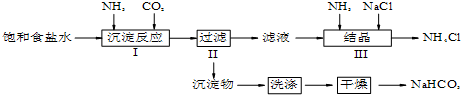
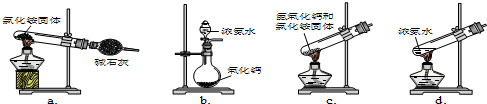
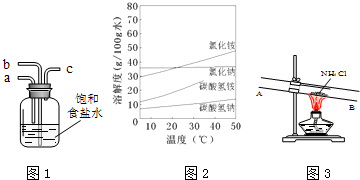
查看答案和解析>>
科目: 来源: 题型:解答题
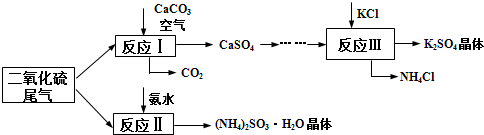
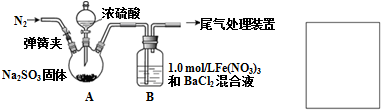
查看答案和解析>>
科目: 来源: 题型:解答题
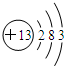 .
.| 元素 | Na | Mg | Al | Si | P | S | Cl |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com