
科目: 来源: 题型:解答题
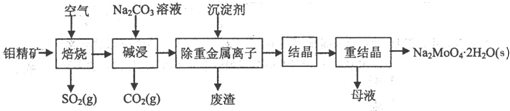

查看答案和解析>>
科目: 来源: 题型:解答题
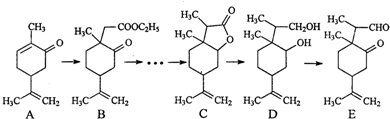
 (任写一种).
(任写一种).查看答案和解析>>
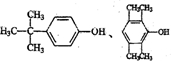
科目: 来源: 题型:解答题
查看答案和解析>>
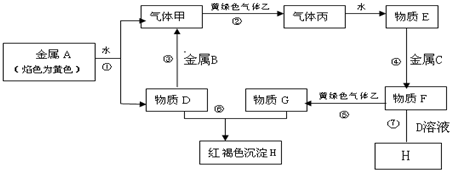
科目: 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 ,该化合物属于离子化合物(填“共价”或“离子”).
,该化合物属于离子化合物(填“共价”或“离子”). ,该化合物含的化学键类型是共价键.
,该化合物含的化学键类型是共价键.查看答案和解析>>
科目: 来源: 题型:解答题
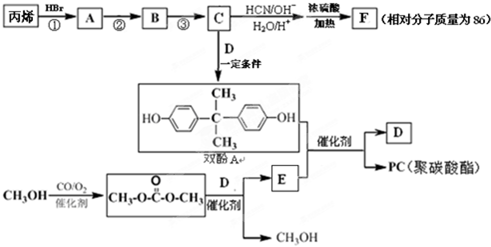

 .
.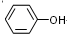 .
. .
.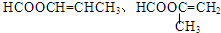 .
.查看答案和解析>>
科目: 来源: 题型:解答题
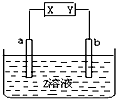 用如图所示电解装置分别完成以下要求,请填空:
用如图所示电解装置分别完成以下要求,请填空:查看答案和解析>>
科目: 来源: 题型:解答题
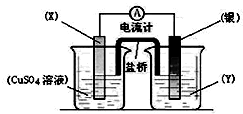 用如图装置实现原电池反应:Cu+2Ag+═Cu2++2Ag
用如图装置实现原电池反应:Cu+2Ag+═Cu2++2Ag查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 二次电池在充电时,电池的负极要与外接电源的负极相连 | |
| B. | 用惰性电极电解硫酸铜溶液一段时间后,加入氢氧化铜可恢复原状 | |
| C. | 化学腐蚀是生活中最常见的一种金属腐蚀 | |
| D. | 燃料电池中的电极材料必须活性不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com