
科目: 来源: 题型:实验题
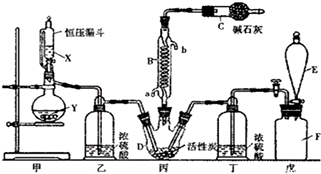
查看答案和解析>>
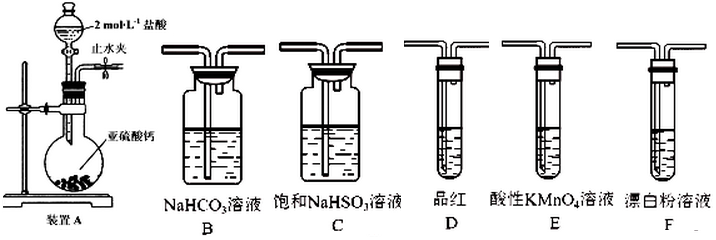
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 由 CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1366.8 kJ•mol-1,可知乙醇的标准燃烧热为1366.8 kJ•mol-1 | |
| B. | 已知:C(金刚石,s)=C(石墨,s)△H<0,则金刚石比石墨稳定 | |
| C. | 已知:N2(g)+O2(g)═2NO(g)△H=+180 kJ•mol-1 2CO(g)+O2(g)═2CO2 (g)△H=-566 kJ•mol-1 则 2CO(g)+2NO(g)═N2 (g)+2CO2(g)△H=-746 kJ•mol-1 | |
| D. | OH-(aq)+H+(aq)═H2O(l)△H=-57.3 kJ•mol-1 |
查看答案和解析>>
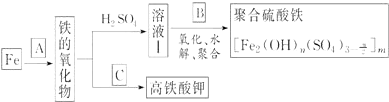
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 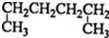 1,4-二甲基丁烷 1,4-二甲基丁烷 | B. | 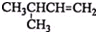 3-甲基丁烯 3-甲基丁烯 | ||
| C. | 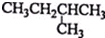 2-甲基丁烷 2-甲基丁烷 | D. | CH2Cl-CH2Cl 二氯乙烷 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)═2CO2(g);△H=-566.0 kJ/mol | |
| B. | 由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s);△H<0 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 已知:2SO2 (g)+O2(g)?2SO3 (g);△H=-98.3 kJ/mol.将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ的热量 |
查看答案和解析>>
科目: 来源: 题型:选择题
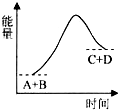
| A. | 是吸热反应 | |
| B. | 生成物的总能量高于反应物的总能量 | |
| C. | 只有在加热条件下才能进行 | |
| D. | 反应中断开化学键吸收的总能量高于形成化学键放出的总能量 |
查看答案和解析>>
科目: 来源: 题型:实验题
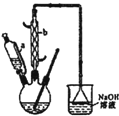 己二酸
己二酸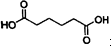 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
| 物质 | 密度(g/cm3) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 | 100 |
| 己二酸 | 1.360/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 | 146 |
查看答案和解析>>
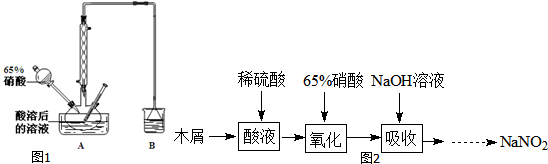
科目: 来源: 题型:实验题
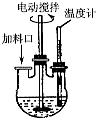 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com