
科目: 来源: 题型:选择题
| A. | 11个质子,12个中子,10个电子 | B. | 18个质子,22个中子,18个电子 | ||
| C. | 16个质子,16个中子,18个电子 | D. | 17个质子,18个中子,17个电子 |
查看答案和解析>>
科目: 来源: 题型:解答题
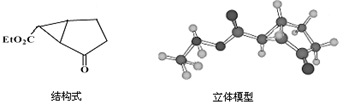
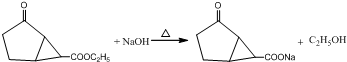 .
.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 原混合物中CuO与Fe2O3的质量比为2:1 | |
| B. | 生成的CO2已被Ba(OH)2溶液完全吸收,Ba2+沉淀完全 | |
| C. | 在吸收CO2后的溶液中有Ba(HCO3)2 | |
| D. | 原混合物中CuO与Fe2O3物质的量的比为l:l |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 吸氧腐蚀比析氢腐蚀更加普遍,因为吸氧腐蚀的速度比析氢腐蚀快 | |
| B. | 铁闸门与直流电源正极相连从而防止闸门腐蚀的方法称为外接直流电源的阴极保护法 | |
| C. | 金属的电化学腐蚀比化学腐蚀更普通 | |
| D. | 用原电池的原理保护金属的方法称为牺牲阳极的阴极保护法 |
查看答案和解析>>
科目: 来源: 题型:多选题
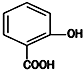
| A. | 可能含有两个醛基 | B. | 可能含有三个羟基 | ||
| C. | 都能与氢氧化钠溶液反应 | D. | 分子式都是C7H6O3 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-→Cl2↑+Mn2++H2O | |
| B. | 将标准状况下1.12 L氯气通入10 mL 1 mol/L的溴化亚铁溶液中:2Fe2++4Br-+3Cl2→2Fe3++6Cl-+2Br2 | |
| C. | 向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:Ca2++HCO3-+OH-→CaCO3↓+H2O | |
| D. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+→BaSO4↓+NH3•H2O+H2O |
查看答案和解析>>
科目: 来源: 题型:实验题
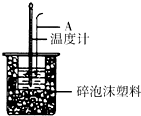 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 25.0 | 25.2 | 28.5 | |
| 2 | 24.9 | 25.1 | 28.4 | |
| 3 | 25.5 | 26.5 | 31.8 | |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 裂化可以提高汽油等轻质油的产量和质量 | |
| B. | 硬脂酸甘油酯皂化反应后得到的主要产品是硬脂酸和甘油 | |
| C. | 乙醇、乙酸、乙酸乙酯分子中均存在-OH | |
| D. | 向2mL苯中加入1mL碘的CCl4溶液,振荡后静置,上层呈紫色 |
查看答案和解析>>
科目: 来源: 题型:实验题
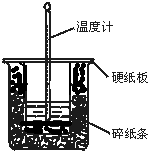 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com