
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
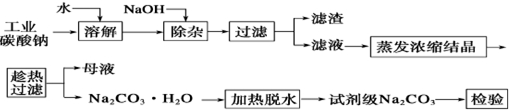
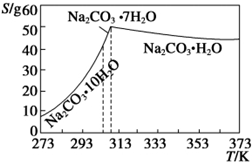
查看答案和解析>>
科目: 来源: 题型:解答题
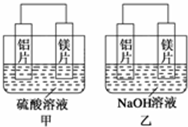 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,4.6gNO2气体约含有1.81×1023个原子 | |
| B. | 在标准状况下,80gSO3所占的体积约为22.4L | |
| C. | 常温下,IL0.lmol/L磷酸溶液含有0.1NA个H+ | |
| D. | 标准状况下,22.4L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA |
查看答案和解析>>
科目: 来源: 题型:推断题
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol•L-1的稀硫酸.
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol•L-1的稀硫酸.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaOH、KOH、CsOH碱性依次减弱 | |
| B. | Li、Na、K、Rb、Cs单质的失电子能力逐渐增强 | |
| C. | Li、Na、K、Rb、Cs的最外层电子数依次减小 | |
| D. | Li、Na、K、Rb、Cs电子层数相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ②④⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642kJ的热量:N2H4(l)+O2(g)═N2(g)+2H2O(g)△H=+642 kJ•mol-1 | |
| B. | 12 g石墨转化为CO时,放出110.5 kJ的热量:2C(石墨,s)+O2(g)═2CO(g)△H=-110.5 kJ•mol-1 | |
| C. | 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286 kJ•mol-1,则:2H2O(l)═2H2(g)+O2(g)的△H=+572 kJ•mol-1 | |
| D. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com