
科目: 来源: 题型:选择题
| A. | 在点燃易燃气体前,必须检验气体的纯度 | |
| B. | 在稀释浓硫酸时,应将浓硫酸用玻璃棒引流慢慢注入水中 | |
| C. | 浓硫酸有腐蚀性,沾到皮肤上,应用较多的水冲洗,再涂上碳酸氢钠稀溶液 | |
| D. | 不得点燃添满酒精的酒精灯 |
查看答案和解析>>
科目: 来源: 题型:解答题
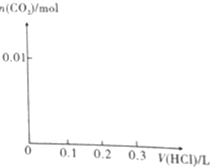 (1)将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol•L-1稀盐酸.在如图所示坐标系中画出能正确表示加入盐酸的体积和生成CO2的物质的量的关系图象.
(1)将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol•L-1稀盐酸.在如图所示坐标系中画出能正确表示加入盐酸的体积和生成CO2的物质的量的关系图象.查看答案和解析>>
科目: 来源: 题型:选择题
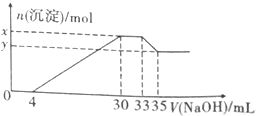 在100ml含Cu2+、Al3+、NH4+、H+、NO3-的溶液中,逐滴加入2.5mol•L-1NaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在100ml含Cu2+、Al3+、NH4+、H+、NO3-的溶液中,逐滴加入2.5mol•L-1NaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )| A. | x-y=2×10-3mol | B. | 原溶液的pH=2 | ||
| C. | 原溶液中n(Cu2+)=0.025mol | D. | 原溶液中c(NH4+)=7.5×10-3mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 滴加KI溶液时,当有2molI-参加反应,则生成1mol白色沉淀 | |
| B. | 通入SO2后溶液逐渐变成无色,体现了SO2的氧化性 | |
| C. | 通入SO2时,SO2与I2反应,I2作还原剂,H2SO4是氧化产物 | |
| D. | 上述实验条件下,物质的还原性:Cu+>I->SO2 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
| 甲 | 乙 | 丙 |
| 柚子 | 黄瓜 | 脐橙 |
| HOCH2COOH | C3H4O5 | 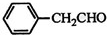 |
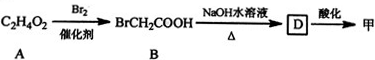
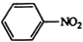 $\stackrel{Fe,HCl}{→}$
$\stackrel{Fe,HCl}{→}$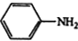 $→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$
$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$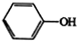
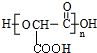 +(n-1)H2O.
+(n-1)H2O.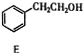 $\stackrel{经两步}{→}$
$\stackrel{经两步}{→}$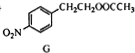 $→_{(2)H+,△}^{(1)Fe,HCl}$$\stackrel{{C}_{8}{H}_{11}NO}{H}$$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$J
$→_{(2)H+,△}^{(1)Fe,HCl}$$\stackrel{{C}_{8}{H}_{11}NO}{H}$$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$J查看答案和解析>>
科目: 来源: 题型:解答题
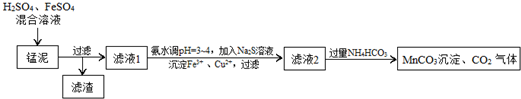
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径的大小顺序为 W>Q>Z>X>Y | |
| B. | 元素 Y 与 W 对应氢化物的沸点 H2Y>H2W | |
| C. | 元素 X 与 Y 可以形成 5 种以上的化合物 | |
| D. | 元素 Q 的最高价氧化物对应的水化物酸性比 W 的强 |
查看答案和解析>>
科目: 来源: 题型:选择题
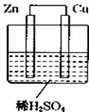 如图所示是 Zn 和 Cu 形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )
如图所示是 Zn 和 Cu 形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )| A. | ②④⑤ | B. | ②③④⑤ | C. | ①④⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com