
科目: 来源: 题型:解答题
 香精里面含有酯类物质,工业上以A为主要原料来合成酯C4H8O2,其合成路线如图所示.其中A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.又知2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.
香精里面含有酯类物质,工业上以A为主要原料来合成酯C4H8O2,其合成路线如图所示.其中A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.又知2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.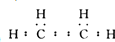
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
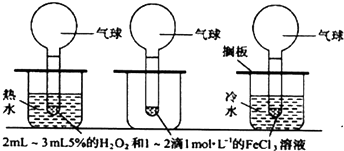
查看答案和解析>>
科目: 来源: 题型:推断题

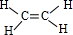
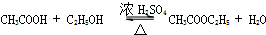 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
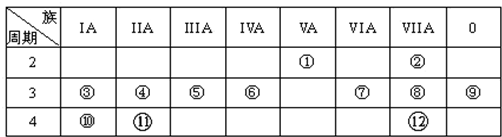
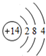
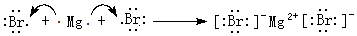 .
.查看答案和解析>>
科目: 来源: 题型:解答题
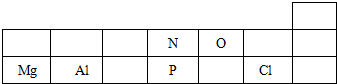
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | |||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ | ||||
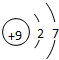 ;最高价氧化物对应的水化物中碱性最强的是NaOH(填化学式)
;最高价氧化物对应的水化物中碱性最强的是NaOH(填化学式)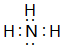 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
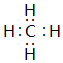
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | a | |||||||
| 二 | d | e | h | |||||
| 三 | b | c | f | g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com