
科目: 来源: 题型:解答题
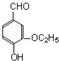 )是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基香草醛分子中两种含氧官能团的名称:酚羟基、醛基,核磁共振氢谱显示该分子中有7种不同类型的氢原子.
)是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基香草醛分子中两种含氧官能团的名称:酚羟基、醛基,核磁共振氢谱显示该分子中有7种不同类型的氢原子.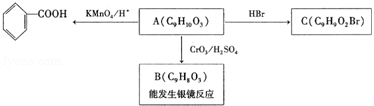
 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型). .
. .
.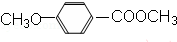 )是一种医药中间体,请设计合理方案用茴香醛(
)是一种医药中间体,请设计合理方案用茴香醛(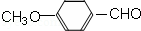 )合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
)合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).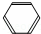 $→_{催化剂△}^{H_{2}}$
$→_{催化剂△}^{H_{2}}$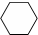 $→_{光照}^{Br_{2}}$
$→_{光照}^{Br_{2}}$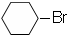
 .
.查看答案和解析>>
科目: 来源: 题型:实验题
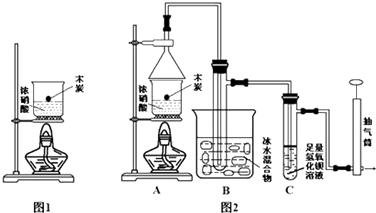
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
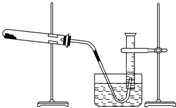 某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量,实验步骤如下:
某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量,实验步骤如下:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 利用丁达尔效应区分溶液和胶体 | |
| B. | 向沸水中滴加饱和的FeCl3溶液制取Fe(OH)3胶体 | |
| C. | 用渗析的方法除去胶体中的离子或分子 | |
| D. | 用滤纸过滤除去溶液中的胶体粒子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al2(SO4)3=2Al3++3SO42- | B. | AlCl3=Al3++Cl3- | ||
| C. | NaHCO3=Na++H++CO32- | D. | KMnO4=K++Mn7++4O2- |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
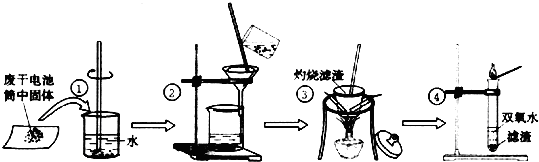
| 实验目的 | 操作 | 实验现象 | 结论 |
| 1.检验Cl- | 取少许滤液于试管中,加入硝酸酸化的硝酸银溶液 | 产生白色沉淀 | 含有Cl- |
| 2.检验NH4+ | 取少许滤液于试管中,加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近 | 石蕊试纸变蓝色 | 含有NH4+ k |
| 3.检验Zn2+ | 取少许滤液于试管中,加入稀氨水 | 先产生白色沉淀,继续加入氨水,沉淀又溶解 | 含有Zn2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com